NS พาสต้าอะตอม ตามชื่อของมัน มันคือมวลของอะตอม ซึ่งมักใช้สัญลักษณ์ว่า “mNS” หรือ “มส.” อย่างไรก็ตาม เนื่องจากอะตอมมีขนาดเล็กมาก ซึ่งมองไม่เห็นด้วยตามนุษย์ จึงเป็นไปไม่ได้ที่จะวัดมวลของอะตอมโดยใช้เครื่องชั่ง เป็นต้น ดังนั้นนักวิทยาศาสตร์จึงกำหนดมวลของอะตอมโดยเปรียบเทียบกับมวลของอะตอมอื่น
สิ่งนี้ทำกับหน่วยอื่นเช่นกัน ตัวอย่างเช่น หน่วยของมวลคือกิโลกรัมมาตรฐาน ซึ่งสอดคล้องกับทรงกระบอกที่มีความสูงและเส้นผ่านศูนย์กลาง 3.917 ซม. ทำจากอิริเดียม 10% และแพลตตินัม 90% ดังนั้นจึงเป็นการเปรียบเทียบ ตัวอย่างเช่น หากเรา "ชั่งน้ำหนัก" วัตถุบนมาตราส่วนและเราพบว่ามวลของมันคือ 10 กก. นั่นหมายความว่ามวลของวัตถุนั้นมากกว่ามาตรฐานที่เลือกไว้ 10 เท่า: 1 กก.
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
เช่นเดียวกับอะตอม มาตรฐานที่เลือกคือคาร์บอน -12 และอะตอมนี้ถูกกำหนดโดยพลการด้วยมวล 12 ยู “u” เป็นหน่วยของมวลอะตอม จึงมีค่าเท่ากับ 1/12 ของมวลอะตอมของคาร์บอน
ตัวอย่างเช่น เมื่อเราพูดว่ามวลอะตอมของไฮโดรเจนเท่ากับ 1 u ก็หมายความว่ามันเหมือนกับ ถ้าเราแบ่งคาร์บอนออกเป็น 12 ส่วน มวลของส่วนใดส่วนหนึ่งเหล่านี้จะเท่ากับมวลของอะตอมของ ไฮโดรเจน อีกตัวอย่างหนึ่งคือกำมะถัน มวลอะตอมของมันคือ 32 u ซึ่งหมายความว่ามวลของมันคือ 32 เท่ามากกว่า 1/12 ของมวลของ
12ค.1 u = 1/12 ของมวล 1 อะตอมของคาร์บอน 12

หน่วยมวลอะตอมคือ 1/12 มวลของคาร์บอน-12
มวลโมเลกุลของสารคือผลรวมของมวลอะตอมของธาตุ ตัวอย่างเช่น มวลอะตอมของออกซิเจนเท่ากับ 16 u ดังนั้นมวลโมเลกุลของโมเลกุลก๊าซออกซิเจน (O2) เท่ากับ 32u
เนื่องจากเทคนิคในห้องปฏิบัติการในปัจจุบันมีความก้าวหน้าอย่างมาก จึงมีอุปกรณ์ที่สามารถวัดมวลอะตอมของธาตุได้อย่างแม่นยำ เช่น แมสสเปกโตรมิเตอร์ จึงสามารถทราบได้ว่า 1 ยู เท่ากับ 1.66054 10-24 NS.
Mind Map: มวลอะตอม

*ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
เนื่องจากมวลอะตอมถูกกำหนดด้วยความแม่นยำอย่างยิ่ง จึงแสดงไว้ในตารางธาตุในรูปของเลขทศนิยม แต่เมื่อเราไปคำนวณ เรามักจะใช้ตัวเลขที่ปัดเศษ ยกเว้นการทดลองที่ต้องแม่นยำมาก ตัวอย่างเช่น หากคุณดูตารางธาตุ คุณจะเห็นว่ามวลอะตอมของออกซิเจนเท่ากับ 15,999 u แต่โดยทั่วไปเราใช้ค่า 16 u ในการคำนวณ สิ่งนี้เกิดขึ้นกับคาร์บอนเช่นกันซึ่งมวลอะตอมได้รับ 12.01 u ดังที่แสดงด้านล่าง:
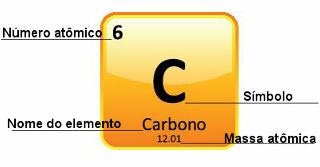
การแสดงคาร์บอนในตารางธาตุ
องค์ประกอบที่ปรากฏในตารางธาตุเป็นค่าเฉลี่ยถ่วงน้ำหนักของไอโซโทปธรรมชาติของธาตุทั้งหมด ดังนั้นมวลอะตอมที่ปรากฏในตารางจึงเป็นค่าเฉลี่ยของมวลอะตอมของธาตุเหล่านี้ด้วย ตัวอย่างเช่น คลอรีน (C?) มีไอโซโทปธรรมชาติสองไอโซโทป 35 และ 37 ซึ่งเปอร์เซ็นต์ในธรรมชาติคือ 75.76% และ 24.24% มวลอะตอมของไอโซโทปเหล่านี้ต่างกัน โดยที่ C?-35 เป็น 34.96885 u และของ C?-37 เท่ากับ 36.96590
ด้วยวิธีนี้ มวลอะตอมของธาตุจะถูกคำนวณโดยคำนึงถึงมวลของไอโซโทปแต่ละชนิดและปริมาณที่ปรากฎในธรรมชาติ ในกรณีของคลอรีน เรามี:
มวลอะตอมของธาตุคลอรีน = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
มวลอะตอมของธาตุคลอรีน = 35.45
นี่คือค่ามวลอะตอมของคลอรีนที่แสดงในตารางธาตุ
* แผนที่ความคิดโดยฉัน Diogo Lopes
โดย เจนนิเฟอร์ โฟกาซา
จบอักษรศาสตร์