นักเคมีชาวฝรั่งเศส อองรี หลุยส์ เลอ ชาเตอลิเยร์ ได้สร้างกฎเคมีที่รู้จักกันดีที่สุดข้อหนึ่ง ซึ่งทำนายการตอบสนองของระบบเคมีในสภาวะสมดุลเมื่อเผชิญกับการเปลี่ยนแปลง
จากผลการศึกษาของเขา เขาได้กำหนดลักษณะทั่วไปสำหรับสมดุลเคมีซึ่งระบุดังต่อไปนี้:
"เมื่อปัจจัยภายนอกกระทำต่อระบบในสภาวะสมดุล มันจะเคลื่อนที่ ในแง่ของการลดการกระทำของปัจจัยที่ใช้"
เมื่อสมดุลของระบบเคมีถูกรบกวน ระบบจะทำงานเพื่อลดการรบกวนนี้ให้เหลือน้อยที่สุดและคืนความเสถียร
ดังนั้น ระบบจึงนำเสนอ:
- สภาวะเริ่มต้นของสมดุล
- สถานะ "ไม่สมดุล" กับการเปลี่ยนแปลงของปัจจัย
- สภาวะสมดุลใหม่ที่ต่อต้านการเปลี่ยนแปลง
ตัวอย่างของการรบกวนจากภายนอกที่อาจส่งผลต่อความสมดุลของสารเคมี ได้แก่
| ปัจจัย | รบกวน | มันถูกสร้างขึ้น |
|---|---|---|
| ความเข้มข้น | เพิ่มขึ้น | บริโภคสาร |
| ลดลง | สารที่ผลิตขึ้น | |
| ความดัน | เพิ่มขึ้น | เลื่อนไปที่ระดับเสียงที่เล็กที่สุด |
| ลดลง | เลื่อนไปที่ระดับเสียงสูงสุด | |
| อุณหภูมิ | เพิ่มขึ้น | ดูดซับความร้อนและเปลี่ยนค่าคงที่สมดุล |
| ลดลง | ปล่อยความร้อนและเปลี่ยนค่าคงที่สมดุล | |
| ตัวเร่ง | การแสดงตน | ปฏิกิริยาเร็วขึ้น |
หลักการนี้มีความสำคัญอย่างยิ่งสำหรับอุตสาหกรรมเคมี เนื่องจากสามารถจัดการปฏิกิริยาและทำให้กระบวนการมีประสิทธิภาพและประหยัดมากขึ้น
ตัวอย่างนี้คือกระบวนการที่พัฒนาโดย Fritz Haber ซึ่งใช้หลักการของ Le Chatelier ในการสร้างเส้นทางเชิงเศรษฐกิจสำหรับการผลิตแอมโมเนียจากไนโตรเจนในบรรยากาศ
ต่อไป เราจะดูดุลยภาพทางเคมีตามกฎของชาเตอลิเยร์และดูว่าการรบกวนสามารถเปลี่ยนแปลงได้อย่างไร
เรียนรู้เพิ่มเติมเกี่ยวกับ:
- สมดุลเคมี
- สมดุลอิออน
- ตัวชี้วัดกรดเบส
ผลความเข้มข้น
เมื่อมีสมดุลเคมี ระบบก็จะสมดุล
ระบบในสภาวะสมดุลอาจเกิดการรบกวนได้เมื่อ:
- เราเพิ่มความเข้มข้นของส่วนประกอบของปฏิกิริยา
- เราลดความเข้มข้นของส่วนประกอบของปฏิกิริยา
เมื่อเราเติมหรือขจัดสารออกจากปฏิกิริยาเคมี ระบบจะต่อต้านการเปลี่ยนแปลง การบริโภค หรือการผลิตสารประกอบนั้นมากขึ้น เพื่อให้เกิดความสมดุลขึ้นใหม่
ความเข้มข้นของสารตั้งต้นและผลิตภัณฑ์เปลี่ยนไปเพื่อปรับให้เข้ากับสมดุลใหม่ แต่ค่าคงที่สมดุลยังคงเหมือนเดิม
ตัวอย่าง:
กับความสมดุล:
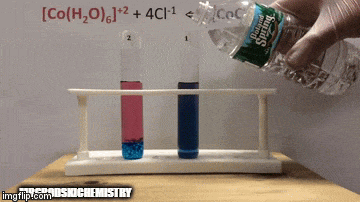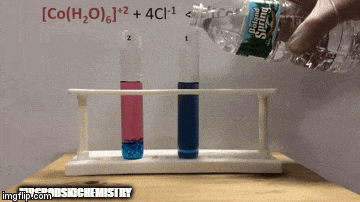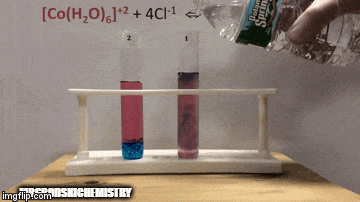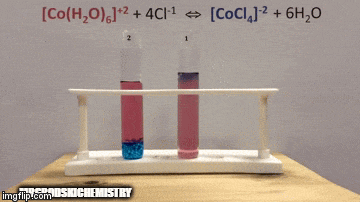
ปฏิกิริยามีความเข้มข้นของผลิตภัณฑ์สูงกว่าเพราะโดยสีฟ้าของสารละลายเราจะเห็นว่า [CoCl complex4]-2 มีอิทธิพลเหนือ
น้ำยังเป็นผลิตภัณฑ์ที่ทำปฏิกิริยาโดยตรงอีกด้วย และเมื่อเราเพิ่มความเข้มข้นของมันในสารละลาย ระบบจะต่อต้านการเปลี่ยนแปลง ทำให้น้ำและสารเชิงซ้อนเกิดปฏิกิริยา
สมดุลถูกเลื่อนไปทางซ้าย ทิศทางปฏิกิริยาย้อนกลับ และทำให้ความเข้มข้นของสารตั้งต้นเพิ่มขึ้น เปลี่ยนสีของสารละลาย
ผลกระทบของอุณหภูมิ
ระบบในสภาวะสมดุลอาจเกิดการรบกวนได้เมื่อ:
- มีการเพิ่มขึ้นของอุณหภูมิของระบบ
- อุณหภูมิของระบบลดลง
เมื่อเติมหรือขจัดพลังงานออกจากระบบเคมี ระบบจะต่อต้านการเปลี่ยนแปลง ดูดซับ หรือปล่อยพลังงานเพื่อให้เกิดความสมดุลขึ้นใหม่
เมื่อระบบเปลี่ยนแปลงอุณหภูมิ ความสมดุลทางเคมีจะเปลี่ยนไปดังนี้:
โดยการเพิ่มอุณหภูมิ ปฏิกิริยาดูดความร้อนเป็นที่โปรดปรานและระบบดูดซับความร้อน
เมื่ออุณหภูมิลดลง จะทำให้เกิดปฏิกิริยาคายความร้อนและระบบจะปล่อยความร้อน
ตัวอย่าง:
ในสมดุลเคมี:
เมื่อเราวางหลอดทดลองที่มีระบบนี้ในบีกเกอร์ที่มีน้ำร้อน อุณหภูมิของระบบจะเพิ่มขึ้นและความสมดุลจะเปลี่ยนเพื่อสร้างผลิตภัณฑ์มากขึ้น

เนื่องจากปฏิกิริยาโดยตรงคือการดูดความร้อนและระบบจะถูกสร้างขึ้นใหม่โดยการดูดซับความร้อน
นอกจากนี้ ความแปรผันของอุณหภูมิยังเปลี่ยนแปลงค่าคงที่สมดุลอีกด้วย
ผลกดดัน Pressure
ระบบในสภาวะสมดุลอาจเกิดการรบกวนได้เมื่อ:
- มีการเพิ่มแรงดันของระบบทั้งหมด
- มีความดันระบบทั้งหมดลดลง
เมื่อเราเพิ่มหรือลดความดันของระบบเคมี ระบบจะต่อต้านการเปลี่ยนแปลงโดยแทนที่ สมดุลในแง่ของปริมาตรที่น้อยกว่าหรือมากกว่าตามลำดับ แต่ไม่เปลี่ยนค่าคงที่สมดุล
เมื่อระบบเปลี่ยนปริมาตร ระบบจะลดการกระทำของแรงดันที่ใช้ ดังนี้:
ยิ่งใช้แรงดันในระบบมากเท่าใด ปริมาตรก็จะหดตัวลงและสมดุลจะเปลี่ยนไปตามจำนวนโมลที่ต่ำกว่า
อย่างไรก็ตาม หากความดันลดลง ระบบจะขยายตัว เพิ่มปริมาตรและทิศทางของปฏิกิริยาจะเปลี่ยนไปเป็นระดับที่มีจำนวนโมลสูงสุด
ตัวอย่าง:
เซลล์ในร่างกายของเราได้รับออกซิเจนผ่านความสมดุลทางเคมี:
ระบบนี้สร้างขึ้นเมื่อออกซิเจนในอากาศที่เราหายใจเข้าไปสัมผัสกับฮีโมโกลบินที่มีอยู่ในเลือด ทำให้เกิดออกซีเฮโมโกลบินซึ่งนำพาออกซิเจน
เมื่อคนปีนขึ้นไปบนภูเขา ระดับความสูงที่สูงกว่า ปริมาณและความดันบางส่วนของ O. จะลดลง2 ขึ้นไปในอากาศ
ความสมดุลของออกซิเจนในร่างกายจะเลื่อนไปทางซ้ายและลดปริมาณออกซิเจน-เฮโมโกลบิน ซึ่งทำให้ปริมาณออกซิเจนที่เซลล์ได้รับลดลง
ผลที่ได้คืออาการวิงเวียนศีรษะและเมื่อยล้าซึ่งอาจทำให้เสียชีวิตได้
ร่างกายพยายามที่จะตอบสนองโดยการผลิตเฮโมโกลบินมากขึ้น อย่างไรก็ตาม นี่เป็นกระบวนการที่ช้า ซึ่งต้องมีการตั้งค่าที่ระดับความสูง

ดังนั้นคนที่สามารถปีนยอดเขาเอเวอเรสต์ได้จึงเป็นคนที่เหมาะที่สุดสำหรับระดับความสูงที่สูงมาก
ตัวเร่งปฏิกิริยา
การใช้ตัวเร่งปฏิกิริยาขัดขวางความเร็วของปฏิกิริยา ทั้งในปฏิกิริยาโดยตรงและปฏิกิริยาย้อนกลับ
เพื่อให้เกิดปฏิกิริยาขึ้น จำเป็นต้องมีพลังงานขั้นต่ำเพื่อให้โมเลกุลชนกันและทำปฏิกิริยาได้อย่างมีประสิทธิภาพ
ตัวเร่งปฏิกิริยาเมื่อใส่เข้าไปในระบบเคมี จะกระทำโดยการลดพลังงานกระตุ้นนี้โดยสร้างสารเชิงซ้อนที่กระตุ้นและสร้างเส้นทางที่สั้นกว่าเพื่อให้เกิดความสมดุลทางเคมี
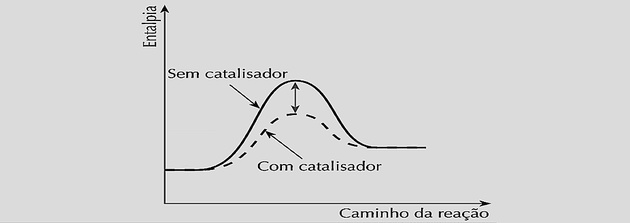
การเพิ่มความเร็วปฏิกิริยาเท่าๆ กัน จะช่วยลดเวลาที่ต้องใช้เพื่อให้ได้สมดุล ดังที่เห็นได้ในกราฟต่อไปนี้
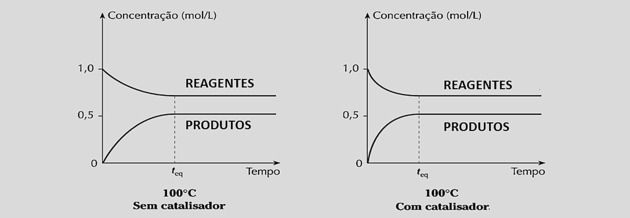
อย่างไรก็ตาม การใช้ตัวเร่งปฏิกิริยาไม่เปลี่ยนผลผลิตของปฏิกิริยาหรือค่าคงที่สมดุลเนื่องจากไม่รบกวนองค์ประกอบของส่วนผสม
การสังเคราะห์แอมโมเนีย
สารประกอบที่มีไนโตรเจนเป็นส่วนประกอบหลักถูกนำมาใช้กันอย่างแพร่หลายในปุ๋ยทางการเกษตร วัตถุระเบิด ยารักษาโรค และอื่นๆ ด้วยเหตุนี้ จึงมีการผลิตสารประกอบไนโตรเจนหลายล้านตัน เช่น NH แอมโมเนีย3, NH แอมโมเนียมไนเตรต4ที่3 และยูเรีย H2NCONH2.
เนื่องจากความต้องการสารประกอบไนโตรเจนทั่วโลก ซึ่งส่วนใหญ่ใช้สำหรับกิจกรรมทางการเกษตร ดินประสิว NaNO ของชิลี3ซึ่งเป็นแหล่งหลักของสารประกอบไนโตรเจน ถูกใช้มากที่สุดจนถึงต้นศตวรรษที่ 20 แต่ดินประสิวธรรมชาติจะไม่สามารถจัดหาความต้องการในปัจจุบันได้
เป็นที่น่าสนใจที่จะสังเกตว่าอากาศในบรรยากาศเป็นส่วนผสมของก๊าซซึ่งประกอบด้วยไนโตรเจน N. มากกว่า 70%2. อย่างไรก็ตามเนื่องจากความเสถียรของพันธะสามตัว มันกลายเป็นกระบวนการที่ยากมากที่จะทำลายพันธะนี้เพื่อสร้างสารประกอบใหม่
วิธีแก้ปัญหานี้เสนอโดย Fritz Haber นักเคมีชาวเยอรมัน การสังเคราะห์แอมโมเนียที่เสนอโดย Haber ทำให้เกิดความสมดุลทางเคมีดังต่อไปนี้:
เพื่อนำไปใช้ในเชิงอุตสาหกรรม กระบวนการนี้จึงสมบูรณ์แบบโดย Carl Bosch และเป็นวิธีที่ใช้มากที่สุดในปัจจุบันในการดักจับไนโตรเจนจากอากาศโดยมุ่งเน้นที่การได้มาซึ่งสารประกอบไนโตรเจน
โดยใช้หลักการของ Le Chatelier ความสมดุลทางเคมีจะเพิ่มขึ้นเมื่อ:
เพิ่ม H2 และทำให้ระบบต่อต้านการเปลี่ยนแปลงและตอบสนองต่อการลดความเข้มข้นของสารตั้งต้นนั้น
ดังนั้น H2 และไม่2 พวกมันถูกใช้ไปพร้อม ๆ กันเพื่อผลิตผลิตภัณฑ์มากขึ้นและสร้างสภาวะสมดุลใหม่
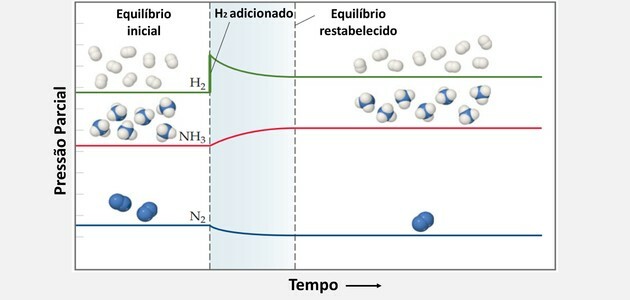
ในทำนองเดียวกัน เมื่อเติมไนโตรเจนมากขึ้น เครื่องชั่งจะเลื่อนไปทางขวา
ในทางอุตสาหกรรม เครื่องชั่งจะเปลี่ยนโดยการกำจัด NH. อย่างต่อเนื่อง3 ของระบบผ่านการคัดเลือกให้เป็นของเหลว เพิ่มผลผลิตของปฏิกิริยา เนื่องจากความสมดุลที่จะสร้างใหม่มีแนวโน้มที่จะสร้างผลิตภัณฑ์มากขึ้น
การสังเคราะห์ Haber-Bosch เป็นหนึ่งในการประยุกต์ใช้การศึกษาสมดุลเคมีที่สำคัญที่สุด
เนื่องจากการสังเคราะห์นี้มีความเกี่ยวข้อง Haber จึงได้รับรางวัลโนเบลสาขาเคมีในปี 1918 และ Bosch ได้รับรางวัลในปี 1931
แบบฝึกหัดกะสมดุล
เมื่อคุณรู้วิธีตีความการเปลี่ยนแปลงที่อาจเกิดขึ้นในสมดุลเคมีแล้ว ให้ใช้คำถามเกี่ยวกับขนถ่ายเหล่านี้เพื่อทดสอบความรู้ของคุณ
1. (UFPE) ยาลดกรดที่เหมาะสมที่สุดควรเป็นยาที่ไม่ลดความเป็นกรดในกระเพาะอาหารมากเกินไป เมื่อความเป็นกรดลดลงมากเกินไป กระเพาะอาหารจะหลั่งกรดส่วนเกินออกมา เอฟเฟกต์นี้เรียกว่า "การแข่งขันของกรด" รายการใดด้านล่างนี้ที่อาจเชื่อมโยงกับเอฟเฟกต์นี้
ก) กฎการอนุรักษ์พลังงาน
b) หลักการกีดกันของ Pauli
c) หลักการของ Le Chatelier
d) หลักการข้อแรกของอุณหพลศาสตร์
จ) หลักการความไม่แน่นอนของไฮเซนเบิร์ก
ทางเลือกที่ถูกต้อง: c) หลักการของ Le Chatelier
ยาลดกรดเป็นเบสอ่อนที่ทำงานโดยการเพิ่มค่า pH ของกระเพาะอาหารและทำให้ความเป็นกรดลดลง
ความเป็นกรดที่ลดลงเกิดจากการทำให้กรดไฮโดรคลอริกในกระเพาะเป็นกลาง อย่างไรก็ตาม การลดความเป็นกรดมากเกินไปก็สามารถสร้างความไม่สมดุลในร่างกายได้ เนื่องจากกระเพาะอาหารทำงานในสภาพแวดล้อมที่เป็นกรด
ตามหลักการของเลอ ชาเตอลิเยร์ เมื่อระบบดุลยภาพถูกรบกวน จะมีการต่อต้านการเปลี่ยนแปลงนี้เพื่อให้เกิดสมดุลขึ้นใหม่
ด้วยวิธีนี้ ร่างกายจะผลิตกรดไฮโดรคลอริกมากขึ้นทำให้เกิดผล "การปรับสภาพกรด"
หลักการอื่น ๆ ที่นำเสนอในทางเลือกที่เกี่ยวข้องกับ:
ก) กฎการอนุรักษ์พลังงาน: ในชุดของการเปลี่ยนแปลง พลังงานทั้งหมดของระบบจะถูกอนุรักษ์ไว้
b) หลักการกีดกันของ Pauli: ในอะตอม อิเล็กตรอนสองตัวไม่สามารถมีเลขควอนตัมชุดเดียวกันได้
d) หลักการข้อแรกของอุณหพลศาสตร์: ความผันแปรของพลังงานภายในระบบคือความแตกต่างระหว่างการแลกเปลี่ยนความร้อนกับงานที่ทำ
จ) หลักการความไม่แน่นอนของไฮเซนเบิร์ก: ไม่สามารถกำหนดความเร็วและตำแหน่งของอิเล็กตรอนได้ในทันที
เกี่ยวกับระบบสมดุลสามารถระบุได้อย่างถูกต้องว่า:
ก) การปรากฏตัวของตัวเร่งปฏิกิริยาส่งผลกระทบต่อองค์ประกอบของส่วนผสม
b) การปรากฏตัวของตัวเร่งปฏิกิริยาส่งผลกระทบต่อค่าคงที่สมดุล
c) ความดันที่เพิ่มขึ้นทำให้ปริมาณCH .ลดลง4(ช).
d) การเพิ่มขึ้นของอุณหภูมิส่งผลต่อค่าคงที่สมดุล
จ) การเพิ่มขึ้นของอุณหภูมิจะทำให้ปริมาณ CO. ลดลง(ช) .
ทางเลือกที่ถูกต้อง: d) การเพิ่มขึ้นของอุณหภูมิส่งผลต่อค่าคงที่สมดุล
เมื่อเพิ่มอุณหภูมิ ปฏิกิริยาโดยตรงซึ่งดูดความร้อนจะได้รับผลกระทบ เนื่องจากการสร้างสมดุลใหม่ ระบบจะดูดซับพลังงานและเลื่อนเครื่องชั่งไปทางขวา
การขยับสมดุลไปในทิศทางตรง ปริมาณของผลิตภัณฑ์ที่เกิดขึ้นจะเพิ่มขึ้น
ค่าคงที่สมดุลเป็นสัดส่วนโดยตรงกับความเข้มข้นของผลิตภัณฑ์ ยิ่งปริมาณของผลิตภัณฑ์มาก ค่าคงที่ก็จะยิ่งมากขึ้น
เราสามารถสังเกตได้ว่าอุณหภูมิที่เพิ่มขึ้นจะเพิ่มปริมาณ CO และ H2.
ความดันที่เพิ่มขึ้นจะเปลี่ยนสมดุลไปเป็นปฏิกิริยาย้อนกลับ เนื่องจากดุลยภาพเคลื่อนไปที่จำนวนโมลที่ต่ำที่สุด ด้วยเหตุนี้ปริมาณ CH4 และ H2เป็นการเสริม
การใช้ตัวเร่งปฏิกิริยาไม่รบกวนค่าคงที่สมดุลและองค์ประกอบของส่วนผสม มันจะทำหน้าที่เพียงเพื่อให้สมดุลได้เร็วยิ่งขึ้นเท่านั้น
3. (UFC) ในการศึกษาการกระทำของก๊าซพิษ COCl2ใช้เป็นอาวุธเคมี สังเกตกระบวนการย่อยสลายตามปฏิกิริยา:
เริ่มต้นจากสถานการณ์สมดุล เพิ่ม 0.10 โมลของ CO และหลังจากนั้นไม่นานระบบก็ถึงสถานการณ์สมดุลใหม่ เลือกตัวเลือกที่ระบุว่าความเข้มข้นสมดุลใหม่สัมพันธ์กับความเข้มข้นเดิมอย่างไร
| [COCl2] | [CO] | [Cl2] | |
| ก) | ใหม่ > เก่า | ใหม่ > เก่า | ใหม่ |
| ข) | ใหม่ > เก่า | ใหม่ > เก่า | ใหม่ > เก่า |
| ค) | ใหม่ | ใหม่ > เก่า | ใหม่ |
| ง) | ใหม่ > เก่า | ใหม่ | ใหม่ |
| และ) | เหมือนกัน | เหมือนกัน | เหมือนกัน |
ทางเลือกที่ถูกต้อง:
| [COCl2] | [CO] | [Cl2] | |
| ก) |
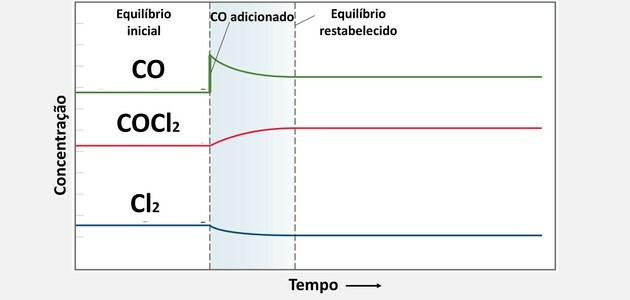
เมื่อมีการเติมสารใหม่ ระบบจะใช้สารนั้นเพื่อคืนความสมดุล เนื่องจากความเข้มข้นของสารนั้นเพิ่มขึ้น
การบริโภคนี้เกิดขึ้นโดยการทำให้สารทำปฏิกิริยากับสารประกอบอื่น ๆ ทำให้เกิดผลิตภัณฑ์มากขึ้น
ดังนั้นเมื่อเราเพิ่มความเข้มข้นของ CO ก็จะมีการบริโภคแต่ไม่ถึงขั้นกลายเป็น ต่ำกว่าความเข้มข้นในสภาวะตั้งต้นเนื่องจากการบริโภคจะเกิดขึ้นควบคู่กันไป องค์ประกอบ
แล้วความเข้มข้นของCl2 จะเล็กกว่าค่าแรกเริ่ม เนื่องจากต้องทำปฏิกิริยากับปริมาณ CO ที่เติมเข้าไป
จากทางแยกของสารทั้งสองความเข้มข้นของ COCl เพิ่มขึ้น2เนื่องจากเป็นผลิตภัณฑ์ที่เกิดขึ้น
การเปลี่ยนแปลงสมดุลเคมีเหล่านี้สามารถเห็นได้ในกราฟด้านล่าง:
4. (UFV) จากการศึกษาทดลองปฏิกิริยาเคมีในสภาวะสมดุลพบว่าการเพิ่มขึ้นของ อุณหภูมิสนับสนุนการก่อตัวของผลิตภัณฑ์ ในขณะที่ความดันที่เพิ่มขึ้นสนับสนุนการก่อตัวของ รีเอเจนต์ จากข้อมูลนี้ และรู้ว่า A, B, C และ D เป็นก๊าซ ให้ทำเครื่องหมายทางเลือกที่แสดงถึงสมการที่ศึกษา:
| ก) | ||
| ข) | ||
| ค) | ||
| ง) | ||
| และ) |
ทางเลือกที่ถูกต้อง:
| ก) |
เมื่ออุณหภูมิเพิ่มขึ้น ระบบจะดูดซับความร้อนเพื่อคืนความสมดุล ด้วยเหตุนี้จึงสนับสนุนปฏิกิริยาดูดความร้อน ซึ่ง ∆H เป็นค่าบวก
ทางเลือกที่สอดคล้องกับความนิยมในการสร้างผลิตภัณฑ์โดยการเพิ่มอุณหภูมิ ได้แก่ a, b และ d
อย่างไรก็ตาม เมื่อความดันเพิ่มขึ้น สมดุลจะเปลี่ยนไปสู่ปริมาตรที่เล็กที่สุด นั่นคือปริมาตรที่มีจำนวนโมลน้อยที่สุด
สำหรับปฏิกิริยาที่จะเคลื่อนเข้าหาตัวทำปฏิกิริยา จำเป็นที่ทิศทางของปฏิกิริยานี้จะต้องมีจำนวนโมลที่สัมพันธ์กับผลิตภัณฑ์น้อยกว่า
นี่เป็นข้อสังเกตในทางเลือกแรกเท่านั้น
5. (UEMG) สมการต่อไปนี้แสดงถึงระบบในภาวะสมดุล ระบบเดียวที่ไม่เปลี่ยนตามแรงดันเปลี่ยนคืออะไร?
ก) OS2(ก.) + 1/2 ออนซ์2(ก.) โซ3(ช)
ข) CO2(ก.) + โฮ2(ก.) ⇔ CO(ช) + โฮ2อู๋(ช)
ค) ไม่2(ก.) + 3 ชั่วโมง2(ก.) ⇔ 2 NH3(ช)
ง) 2 CO2(ก.) ⇔ 2 CO(ช) + โอ2(ก.)
ทางเลือกที่ถูกต้อง: b) CO2(ก.) + โฮ2(ก.) ⇔ CO(ช) + โฮ2อู๋(ช)
เมื่อระบบเปลี่ยนความดันรวม ความสมดุลจะถูกสร้างขึ้นใหม่พร้อมกับการเปลี่ยนแปลงของปริมาตร
ถ้าความดันเพิ่มขึ้น ปริมาตรจะลดลง เปลี่ยนสมดุลให้เป็นจำนวนโมลที่น้อยที่สุด
ในทางกลับกัน เมื่อความดันลดลง ปริมาตรจะเพิ่มขึ้น ส่งผลให้สมดุลมีโมลมากขึ้น
แต่เมื่อมีจำนวนโมลของสารที่ทำปฏิกิริยาและผลิตภัณฑ์เกิดขึ้นเท่ากัน ไม่มีทางที่จะเปลี่ยนสมดุลได้ เนื่องจากปริมาตรไม่เปลี่ยนแปลง
เราทราบจำนวนโมลด้วยสัมประสิทธิ์ปริมาณสัมพันธ์ถัดจากสารแต่ละชนิด
เราสามารถเห็นสิ่งนี้ในสมการทางเลือก
ข) CO2(ก.) + โฮ2(ก.) ⇔ CO(ช) + โฮ2อู๋(ช)
โดยที่ CO. 1 โมล2 ทำปฏิกิริยากับ H. 1 โมล2 เพื่อสร้าง 1 โมลของ CO และ 1 โมลของ H2โอ.
ในปฏิกิริยาทั้งสองทิศทางมี 2 โมล ดังนั้นการเปลี่ยนแปลงของความดันจะไม่เปลี่ยนปริมาตร
ตรวจสอบคำถามเพิ่มเติมเกี่ยวกับการกระจัดสมดุลเคมีพร้อมความละเอียดแสดงความคิดเห็นในรายการนี้เราได้เตรียม: แบบฝึกหัดสมดุลเคมี.
Le Chatelier คือใคร?




