โมเลกุลคือการจัดกลุ่มที่เสถียรของอะตอมตั้งแต่สองอะตอมขึ้นไป ซึ่งเหมือนกันหรือต่างกัน เชื่อมต่อกันผ่านพันธะโควาเลนต์
สารประกอบโมเลกุลถูกจำแนกตามขั้ว
- โมเลกุล Apolar: ไม่มีความแตกต่างในอิเล็กโตรเนกาติวีตี้ระหว่างอะตอม
- โมเลกุลขั้วโลก: มีความแตกต่างของอิเล็กโตรเนกาติวีตี้ระหว่างอะตอมกับขั้วบวกและขั้วลบ
เมื่อโมเลกุลเกิดจากองค์ประกอบทางเคมีมากกว่าหนึ่งชนิด จำนวนเมฆอิเล็กทรอนิกส์และลิแกนด์ที่ส่งไปยังอะตอมกลางจะเป็นตัวกำหนดขั้ว
โมเลกุลไม่มีขั้ว
โมเลกุลมีอะตอมของพวกมันเชื่อมต่อกันด้วยพันธะโควาเลนต์ กล่าวคือ มีการใช้อิเล็กตรอนร่วมกัน
อิเล็กโตรเนกาติวีตี้ มันคือความสามารถของอะตอมในการดึงดูดอิเล็กตรอนเข้าสู่ตัวมันเองในพันธะ ก่อตัวเป็นขั้วในโมเลกุล
อะตอมที่ดึงดูดอิเล็กตรอนจะกลายเป็นขั้วลบโดยการสะสมของประจุลบและอีกอะตอมจะกลายเป็นขั้วบวก
เมื่อโมเลกุลถูกสร้างขึ้นโดยอะตอมขององค์ประกอบทางเคมีเดียว ไม่มีความแตกต่างของอิเล็กโตรเนกาติวีตี้และโมเลกุลคือ ละเลย.

โมเลกุลของสารง่าย ๆ เช่น O2 และไม่2, ถูกสร้างขึ้นโดย อะตอม ขององค์ประกอบเดียวกัน ในทางกลับกัน โมเลกุลของสารผสมมีองค์ประกอบที่แตกต่างกันอย่างน้อยสององค์ประกอบ

ที่ โมเลกุล CO2 และ BeH2 พวกมันไม่มีขั้วเนื่องจากเรขาคณิต เนื่องจากทั้งคู่มีเรขาคณิตเชิงเส้น อะตอมที่ส่วนปลาย ออกซิเจน และไฮโดรเจน ดึงดูดอิเล็กตรอนของพันธะเข้าหากัน เนื่องจากมีอิเล็กโตรเนกาติตีมากกว่า
แรงดึงดูดของอะตอมทางด้านซ้ายจะถูกถ่วงดุลโดยแรงดึงดูดของอะตอมทางด้านขวา เนื่องจากพันธะเหมือนกัน กล่าวคือ มีความเข้มเท่ากัน แต่มีทิศทางต่างกัน โมเลกุลจึงไม่เกิดเป็นขั้ว
โมเลกุลขั้ว
เมื่อโมเลกุลถูกสร้างขึ้นโดยอะตอมที่แตกต่างกัน จะมีความแตกต่างของอิเล็กโตรเนกาติวีตี้ แต่มันคือ เรขาคณิตโมเลกุล ซึ่งกำหนดว่าจะมีขั้วหรือไม่มีขั้ว
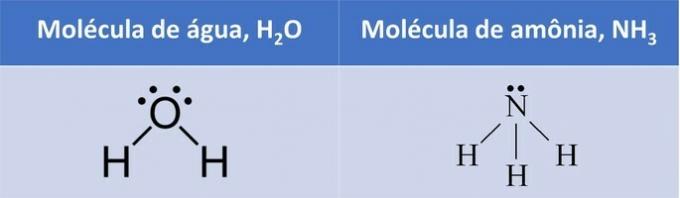
ในทั้งสองตัวอย่าง เราจะเห็นว่าอะตอมกลาง ออกซิเจน และไนโตรเจน มีคู่อิเล็กตรอนที่ไม่คู่กันซึ่งก่อตัวเป็นเมฆอิเล็กตรอน
เนื่องจากมีเมฆอิเล็กตรอนอยู่รอบๆ อะตอมกลางมากกว่าจำนวนอะตอมที่เท่ากัน โมเลกุลจึงเป็น ขั้วโลก.
ด้วยการก่อตัวของเมฆอิเล็กทรอนิกส์ โมเลกุลจะถือว่าโครงสร้างที่รองรับอะตอมได้ดีกว่า ดังนั้น เรขาคณิตของน้ำจึงเป็นเชิงมุมและแอมโมเนียเสี้ยม
ต้องการเพิ่มพูนความรู้ของคุณ? อย่าพลาดข้อความด้านล่าง!
- ชีวโมเลกุล
- แรงระหว่างโมเลกุล
- สูตรโมเลกุล
- มวลโมเลกุล
ออกกำลังกายด้วยการแสดงความคิดเห็น
1. ระบุขั้วของโมเลกุล:
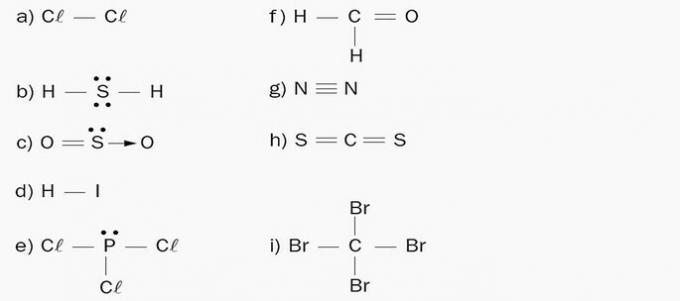
ก) Apolar โมเลกุลประกอบด้วยองค์ประกอบทางเคมีเดียวคือคลอรีน เนื่องจากไม่มีความแตกต่างของอิเล็กโตรเนกาติวีตี้ จึงไม่เกิดขั้ว
ข) ขั้วโลก มีเมฆอิเล็กตรอน 4 ก้อนและอะตอมเท่ากัน 2 อะตอม (H) ติดอยู่กับองค์ประกอบกลาง (S)
ค) โพลาร์ มีเมฆอิเล็กทรอนิกส์ 3 ก้อนและอะตอมเท่ากัน 2 อะตอม (O) ติดอยู่กับองค์ประกอบกลาง (S)
ง) ขั้วโลก องค์ประกอบของโมเลกุลมีอิเล็กโตรเนกาติวีตี้ต่างกัน ขั้วลบก่อตัวขึ้นในไอโอดีนเนื่องจากการสะสมของประจุลบ และด้วยเหตุนี้ ด้านไฮโดรเจนจึงเกิดเป็นขั้วบวก
จ) ขั้วโลก มีเมฆอิเล็กตรอน 4 ก้อนและอะตอมเท่ากัน 3 ตัว (Cl) ติดอยู่ที่องค์ประกอบกลาง (P)
ฉ) โพลาร์ มีการกระจายประจุแบบอสมมาตรบนโมเลกุล เนื่องจากคาร์บอนมีลิแกนด์ต่างกัน
g) Apolar โมเลกุลเป็นไดอะตอมมิกและเกิดขึ้นจากอะตอมขององค์ประกอบทางเคมีเดียวกัน ดังนั้นจึงไม่มีความแตกต่างในอิเล็กโตรเนกาติวีตี้
ซ) อะโพลาร์ จำนวนเมฆอิเล็กตรอนเท่ากับจำนวนอะตอมที่ติดอยู่กับอะตอมกลาง
ผม) Apolar จำนวนเมฆอิเล็กตรอนเท่ากับจำนวนอะตอมที่ติดอยู่กับอะตอมกลาง
2. (Fuvest) พิจารณาโมเลกุลของ HF, HCl, H2โอ โฮ2, O2 และ CH4.
ก) จำแนกโมเลกุลเหล่านี้ออกเป็นสองกลุ่ม: แบบมีขั้วและไม่มีขั้ว
| โพลาร์ | โพลาร์ |
|---|---|
| ไฮโดรเจนฟลูออไรด์ (HF) | โมเลกุลไฮโดรเจน (H2) |
| ไฮโดรเจนคลอไรด์ (HCl) | โมเลกุลออกซิเจน (O2) |
| น้ำ (H2อ) | มีเทน (CH4) |
HF, HCl และ H2มีขั้วเพราะในสารประกอบทั้งสามไฮโดรเจนถูกจับกับองค์ประกอบที่มีอิเล็กโตรเนกาทีฟมาก
โฮ2 มันเป็น2 พวกมันไม่มีขั้วเนื่องจากไม่มีความแตกต่างของอิเล็กโตรเนกาติวีตี้ในโมเลกุล CH4 มันก็ไม่มีขั้วเช่นกันเพราะจำนวนเมฆอิเล็กตรอนนั้นเท่ากับจำนวนขององค์ประกอบที่ติดอยู่กับอะตอมกลางคือคาร์บอน
คุณสมบัติที่อ้างถึงอะตอม: อิเล็กโตรเนกาติวีตี้.
โมเลกุลที่ประกอบด้วยอะตอมขององค์ประกอบทางเคมีเพียงชนิดเดียวถูกจัดประเภทเป็นไม่มีขั้ว เนื่องจากไม่มีความแตกต่างในอิเล็กโตรเนกาติวีตี้
คุณสมบัติที่เกี่ยวข้องกับโมเลกุล: ปริมาณเมฆและจำนวนลิแกนด์เท่ากัน.
โมเลกุลที่เกิดจากอะตอมขององค์ประกอบทางเคมีที่แตกต่างกันถูกจัดประเภทเป็นขั้วหรือไม่มีขั้วตามจำนวนของเมฆอิเล็กทรอนิกส์และปริมาณของลิแกนด์ต่ออะตอมกลาง
น้ำมีขั้วเพราะอะตอมกลาง ออกซิเจน มีอิเล็กตรอนคู่ไม่คู่กัน ทำให้มีเมฆอิเล็กตรอน 3 ก้อน และลิแกนด์ 2 ตัว ดังนั้นการกระจายประจุจึงไม่สมมาตร ทำให้เกิดขั้วในโมเลกุล
มีเทนไม่มีขั้ว เนื่องจากอะตอมกลาง คาร์บอน มีจำนวนลิแกนด์เท่ากับจำนวนเมฆอิเล็กทรอนิกส์ ทำให้มีรูปทรงจัตุรมุขเรขาคณิต และไม่มีขั้วในโมเลกุล
3. (Vunesp) จากทางเลือกอื่นด้านล่าง ให้ระบุรายการที่มีข้อความสั่งไม่ถูกต้อง:
ก) พันธะโควาเลนต์เป็นพันธะที่เกิดขึ้นจากการแบ่งปันอิเล็กตรอนระหว่างสองอะตอม
ข) สารประกอบโควาเลนต์ HCl มีขั้วเนื่องจากความแตกต่างของอิเล็กโตรเนกาติวีตี้ที่มีอยู่ระหว่างอะตอมของไฮโดรเจนและคลอรีน
c) สารประกอบที่เกิดขึ้นระหว่างโลหะอัลคาไลและฮาโลเจนเป็นโควาเลนต์
ง) สารตามสูตร Br2 มันไม่มีขั้ว
จ) สารตามสูตร Cal2 มันคืออิออน
ทางเลือกที่ไม่ถูกต้อง: c) สารประกอบที่เกิดขึ้นระหว่างโลหะอัลคาไลและฮาโลเจนเป็นโควาเลนต์
ก) ถูกต้อง พันธะประเภทนี้สอดคล้องกับการแบ่งอิเล็กตรอนโดยทั่วไประหว่างอโลหะ
ข) ถูกต้อง คลอรีนมีอิเล็กโตรเนกาติวีตี้มากกว่าไฮโดรเจน ดังนั้นจึงดึงดูดคู่อิเล็กตรอนจากพันธะมาที่ตัวมันเอง ทำให้เกิดความไม่สมดุลของประจุ
โมเลกุล HCl เป็นขั้วเนื่องจากขั้วลบก่อตัวในคลอรีนเนื่องจากการสะสมของประจุลบและ, ดังนั้น ด้านไฮโดรเจนจึงมีแนวโน้มที่จะมีประจุบวกสะสม ก่อตัวเป็นขั้ว บวก.
ค) ไม่ถูกต้อง พันธะไอออนิกทำให้โลหะสามารถบริจาคอิเล็กตรอนและคงประจุบวกทำให้เกิดไอออนบวกได้ ในทางกลับกัน ฮาโลเจนจะรับอิเล็กตรอนและก่อตัวเป็นแอนไอออน ซึ่งเป็นสายพันธุ์ที่มีประจุลบ
ง) ถูกต้อง โมเลกุลเป็นไดอะตอมมิกและเกิดขึ้นจากอะตอมขององค์ประกอบทางเคมีเดียวกัน ดังนั้นจึงไม่มีความแตกต่างในอิเล็กโตรเนกาติวีตี้
จ) ถูกต้อง ในพันธะไอออนิก อะตอมจะบริจาคหรือรับอิเล็กตรอน ในสารประกอบไอออนิก แคลเซียมจะบริจาคอิเล็กตรอนสองตัวและสร้างไอออนบวก Ca2+. ไอโอดีนรับอิเล็กตรอนจากแคลเซียมและสร้างสปีชีส์ที่มีประจุลบ I2-.
อย่าลืมตรวจสอบข้อความเหล่านี้ในประเด็นที่เกี่ยวข้องกับหัวข้อของเนื้อหานี้:
- พันธะไอออนิก
- พันธะโควาเลนต์
- ขั้วของการเชื่อมต่อ
- สารธรรมดาและสารผสม
- คุณสมบัติทั่วไปของสสาร