อิเล็กโทรลิซิส เป็นกระบวนการทางกายภาพและเคมีที่ใช้พลังงานไฟฟ้าจากแหล่งใด ๆ (เช่น แบตเตอรี่ หรือแบตเตอรี) เพื่อบังคับให้เกิดปฏิกิริยาเคมีเพื่อผลิตสารธรรมดาหรือสารผสมที่ไม่สามารถพบได้ในธรรมชาติหรือที่ไม่พบในปริมาณมาก
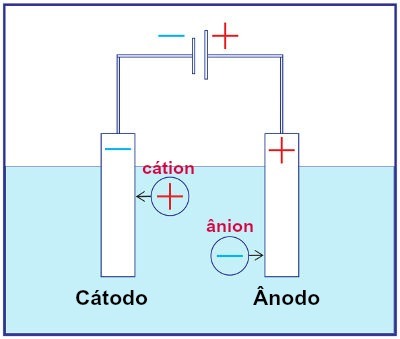
เป็นตัวแทนของการประกอบระบบอิเล็กโทรลิซิสใด ๆ
ในระหว่างการแยกอิเล็กโทรไลซิส ไอออนบวกจะถูกรีดักชันที่แคโทด และแอนไอออนจะเกิดปฏิกิริยาออกซิเดชันที่แอโนด สิ่งนี้เกิดขึ้นจากการคายประจุไฟฟ้าจากแหล่งภายนอก ดังนั้น ในอิเล็กโทรลิซิส เรามีปฏิกิริยาออกซิเดชันและรีดักชันที่ไม่เกิดขึ้นเอง
มาทำความเข้าใจสองวิธีที่อิเล็กโทรไลซิสเกิดขึ้น:
ในอิเล็กโทรไลซิสประเภทนี้ เราใช้ a สารไอออนิก ในสถานะของเหลวในถังอิเล็กโทรไลต์ เมื่อสารไอออนิก (XY) ผ่านการหลอมรวม จะผ่านกระบวนการของ ความแตกแยกดังที่แสดงด้านล่าง:
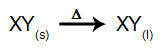

จากนั้นเมื่อเปิดแหล่งพลังงาน ไอออนบวก (X+) เคลื่อนที่ไปทางแคโทดและแอนไอออน (Y-) เคลื่อนไปทางแอโนด ด้วยเหตุนี้:
ที่แคโทด: ไอออนบวกได้รับอิเล็กตรอน (ลดลง) และเปลี่ยนเป็นสารที่เสถียร (X) ซึ่งเป็นกระบวนการที่แสดงโดยสมการต่อไปนี้:
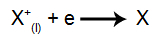
ที่ขั้วบวก: แอนไอออนสูญเสียอิเล็กตรอน (เกิดปฏิกิริยาออกซิเดชัน) และกลายเป็นสารที่เสถียร (X) ซึ่งเป็นกระบวนการที่แสดงโดยสมการต่อไปนี้:

ก) ตัวอย่างของอิเล็กโทรไลซิสอัคนี
ตัวอย่างเช่น ให้ทำตามอิเล็กโทรลิซิสของอิเล็กโทรไลต์ของ เกลือแกง (NaCl). เมื่อโซเดียมคลอไรด์ (NaCl) ผ่านการหลอมรวม จะผ่านกระบวนการแยกตัวออกดังที่แสดงด้านล่าง:
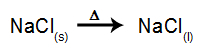
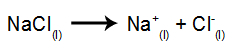
จากนั้นเมื่อเปิดแหล่งพลังงาน ไอออนบวก (Na+) เคลื่อนไปทางแคโทดและแอนไอออน (Cl-) เคลื่อนไปทางแอโนด ด้วยเหตุนี้:
ที่แคโทด: ไพเพอร์ใน+ พวกมันได้รับอิเล็กตรอน (ลดลง) และกลายเป็นสารที่เสถียร (Na ซึ่งเป็นโลหะแข็ง) ซึ่งเป็นกระบวนการที่แสดงโดยสมการด้านล่าง:

ที่ขั้วบวก: Cl แอนไอออน- พวกมันสูญเสียอิเล็กตรอน (เกิดปฏิกิริยาออกซิเดชัน) และกลายเป็นสารที่เสถียร (Cl2ซึ่งเป็นก๊าซ) กระบวนการแสดงโดยสมการด้านล่าง:

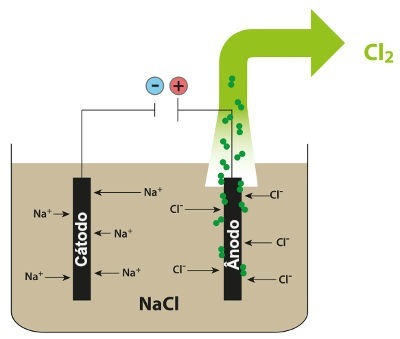
โครงการแสดงให้เห็นถึงอิเล็กโทรไลซิสของ NaCl
ดังนั้น ในกระบวนการอิเล็กโทรไลซิสของโซเดียมคลอไรด์ เราจึงมีโซเดียมโลหะ (Na) และก๊าซคลอรีน (Cl2).
ในอิเล็กโทรไลซิสประเภทนี้ เราใช้สารไอออนิกที่ละลายในน้ำ ภายในถังอิเล็กโทรไลต์ ดังนั้น ก่อนทำอิเล็กโทรลิซิส เราผสมสารก่อน (ปกติคือเกลือus อนินทรีย์) ในน้ำเพื่อทำให้เกิดการแตกตัว (ปล่อยประจุบวกและประจุลบ) ดังภาพ ร้อง:
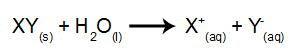
ความแตกต่างในความสัมพันธ์กับอิเล็กโทรไลซิสที่เกิดจากการแตกตัวของไอออนคือ นอกจากไอออนจากการแตกตัวแล้ว เรายังมีไอออนจากการแตกตัวเป็นไอออนในตัวของน้ำด้วย ในการแตกตัวเป็นไอออนในตัวเอง น้ำจะผลิตไฮโดรเนียมไอออนบวก (H+) และไฮดรอกไซด์แอนไอออน (OH-) ดังสมการด้านล่าง

ดังนั้น ภายในถังอิเล็กโทรไลต์ เรามีไอออนบวกอยู่ 2 ตัว (ตัวหนึ่งมาจากสาร ไอออนิกและอีกอันจากน้ำ) และแอนไอออนสองอัน (อันหนึ่งมาจากสารไอออนิกและอีกอันมาจาก น้ำ).
หากต้องการทราบว่าประจุบวกตัวใดจะเคลื่อนไปที่ขั้วลบและประจุลบตัวใดจะเคลื่อนที่ไปยังขั้วบวก จำเป็นต้องทราบลำดับการปลดปล่อยประจุบวกและประจุลบ
สำหรับไพเพอร์:
Au>Pt>Hg>Ag>Cu>Ni>Cd>Pb>Fe>Zn>Mn>ไฮโดรเนียม>ตระกูล IIIA> ตระกูล IIA > ตระกูล IA
สำหรับแอนไอออน
แอนไอออนที่ไม่มีออกซิเจนและ HSO4 > ไฮดรอกไซด์ > แอนไอออนออกซิเจนและ F
จากนั้นเมื่อเปิดแหล่งพลังงาน ไอออนบวก (X+) เคลื่อนไปทางแคโทดและหนึ่งในแอนไอออน (Y-) เคลื่อนที่ไปทางแอโนด
ที่แคโทด: ไอออนบวกได้รับอิเล็กตรอน (ลดลง) และเปลี่ยนเป็นสารที่เสถียร (X) ซึ่งเป็นกระบวนการที่แสดงโดยสมการด้านล่าง:

ที่ขั้วบวก: แอนไอออนสูญเสียอิเล็กตรอน (เกิดปฏิกิริยาออกซิเดชัน) และกลายเป็นสารที่เสถียร (Y) ซึ่งเป็นกระบวนการที่แสดงโดยสมการด้านล่าง:
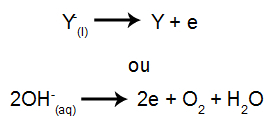
ก) ตัวอย่างอิเล็กโทรไลซิสในน้ำ
ตัวอย่างเช่น เราจะใช้อิเล็กโทรลิซิสในน้ำของโซเดียมคลอไรด์ (NaCl) เมื่อโซเดียมคลอไรด์ (NaCl) ละลายในน้ำ จะผ่านกระบวนการแยกตัวออกดังที่แสดงด้านล่าง:
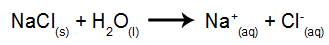
นอกจากการแยกตัวของ NaCl แล้ว เรายังมีการแตกตัวเป็นไอออนในน้ำ:

ดังนั้นเราจึงมี H cations+ และต่อไป+ และ OH แอนไอออน- และ Cl-. จากนั้นเมื่อเปิดแหล่งพลังงานแล้ว เรามีสิ่งต่อไปนี้:
ที่แคโทด: H ไพเพอร์+ รับอิเล็กตรอน (ลดลง) และกลายเป็นสารที่เสถียร (H2ซึ่งเป็นก๊าซ) นี่เป็นเพราะว่าไฮโดรเนียมมีความสำคัญในการปล่อยประจุเหนือองค์ประกอบของตระกูล IA (ในกรณีนี้คือ Na) กระบวนการนี้แสดงโดยสมการด้านล่าง:
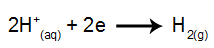
ที่แอโนด: Cl แอนไอออน- พวกมันสูญเสียอิเล็กตรอน (เกิดปฏิกิริยาออกซิเดชัน) และกลายเป็นสารที่เสถียร (Cl2ซึ่งเป็นก๊าซ) ทั้งนี้เป็นเพราะCl- เป็นประจุลบที่ไม่มีออกซิเจนและมีลำดับความสำคัญในการปล่อยประจุเหนือไฮดรอกไซด์ ซึ่งเป็นกระบวนการที่แสดงโดยสมการด้านล่าง:


โครงการแสดงให้เห็นถึงอิเล็กโทรไลซิสของNaCl
ดังนั้น ในอิเล็กโทรไลซิสของโซเดียมคลอไรด์ในน้ำ เราจึงมีการก่อตัวของก๊าซไฮโดรเจน (H2) และก๊าซคลอรีน (Cl2).
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm
