ที่ ปฏิกิริยาความชุ่มชื้นใน อัลคาเดียนdie พวกเขาเป็น ปฏิกิริยาการเติมกล่าวคือ ส่วนประกอบ (ไฮโดรเนียมและไฮดรอกไซด์) ของโมเลกุลน้ำจะถูกเติมลงในอัลคาไดอีน
คุณ อัลคาเดียนdie เป็นไฮโดรคาร์บอนที่มีสายโซ่เปิดและมีพันธะคู่สองพันธะ (เกิดขึ้นจากซิกมาและพาย) ระหว่างคาร์บอน ดังที่เราเห็นในโครงสร้างต่อไปนี้:

สูตรโครงสร้างของอัลคาเดียน
สำหรับ ปฏิกิริยาการให้น้ำในอัลคาเดียน ถูกดำเนินการ มันเป็นสิ่งสำคัญที่พันธะ pi ที่มีอยู่ในพันธะคู่จะถูกทำลายโดยอิทธิพลของความร้อนและกรดซัลฟิวริก (H2เท่านั้น4). ด้วยการแตกของพันธะ pi ไซต์ของพันธะสองแห่งจะปรากฏขึ้น โดยแต่ละไซต์อยู่บนคาร์บอนตัวใดตัวหนึ่งที่เกี่ยวข้องกับพันธะคู่

การเกิดขึ้นของไซต์ที่มีผลผูกพันกับการหยุดชะงักของ pi binding
การปรากฏตัวของตำแหน่งจับบนโมเลกุลอัลคาเดียนเป็นสิ่งจำเป็นสำหรับไอออน (H+ และโอ้-) จากน้ำจะถูกเติมลงในอัลคาเดียน ก่อตัวขึ้น เช่น ไดอัลคอฮอล (แอลกอฮอล์ ด้วยไฮดรอกซิลสองตัว)
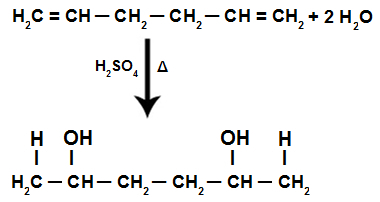
การเพิ่มของ H+ และโอ้- ในโครงสร้างของอัลคาเดียน
บันทึก: การเพิ่มของ H+ และโอ้- ในโครงสร้างอัลคาเดียนตาม กฎของมาร์คอฟนิคอฟ, คือ H+ จับกับคาร์บอนที่เติมไฮโดรเจนมากที่สุด และ OH- จับกับคาร์บอนที่เติมไฮโดรเจนน้อย

ตัวอย่างการประยุกต์ใช้กฎ Markovnikov ในการให้น้ำของอัลคาเดียน
เนื่องจากมีอัลคาเดียนหลายประเภทที่สัมพันธ์กับตำแหน่งของพันธะคู่ อาจเป็นไปได้ว่าไฮเดรชั่นของอัลคาไดอีนจะสร้างสารประกอบต่างกัน ดูกรณีต่อไปนี้:
→ อัลคาเดียนที่สะสมหรือควบแน่น
เป็นอัลคาเดียนที่มีพันธะคู่สองพันธะพร้อมๆ กันซึ่งเกี่ยวข้องกับอะตอมของ three คาร์บอน กล่าวคือ ไม่มีพันธะเดี่ยวที่แยกคาร์บอนที่เกี่ยวข้องกับพันธะออก คู่

สูตรโครงสร้างของอัลคาเดียนสะสม
ในระหว่างปฏิกิริยาไฮเดรชั่นของอัลคาเดียนสลับกัน พันธะ pi จะแตกออกเป็น H+ เพิ่มคาร์บอนไฮโดรเจนมากขึ้นและOH- เพิ่มคาร์บอนไฮโดรเจนน้อย:
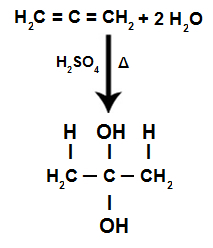
สมการปฏิกิริยาอัลคาเดียนไฮเดรชันสะสม
เรามีว่าในการให้น้ำของอัลคาเดียนที่สะสม อะตอมของคาร์บอนตัวเดียวกันจะได้รับไฮดรอกซิลสองตัว ก่อตัวเป็นแอลกอฮอล์คู่ ซึ่งเป็นโครงสร้างที่ไม่เสถียร

โครงสร้างของแอลกอฮอล์แฝด
เนื่องจากแอลกอฮอล์คู่ไม่เสถียร เราจึงมีการก่อตัวของโมเลกุลน้ำที่มีส่วนประกอบของไฮดรอกซิลสองตัวและการสร้างพันธะ pi ระหว่างคาร์บอนกับออกซิเจน

การก่อตัวของคีโตนจากแอลกอฮอล์คู่
ดังนั้น ปฏิกิริยาไฮเดรชั่นของอัลคาเดียนที่สะสมจะส่งผลให้เกิดการก่อตัวของ a คีโตน.
→ คอนจูเกตหรืออัลคาเดียนสำรอง alternate
เป็นอัลคาเดียนที่มีพันธะคู่สองพันธะพร้อม ๆ กันซึ่งเกี่ยวข้องกับสี่ อะตอมของคาร์บอน กล่าวคือ มีพันธะเดี่ยวที่แยกคาร์บอนที่เกี่ยวข้องกับพันธะออก คู่
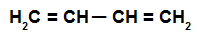
สูตรโครงสร้างของอัลคาเดียนสลับกัน
ในการสลับอัลคาเดียนจะเกิดการกำทอนของพันธะคู่ ดังนั้นอิเล็กตรอนของตำแหน่งเปลี่ยนพันธะ pi (ลูกศรสีแดง) ดังในแผนภาพต่อไปนี้:
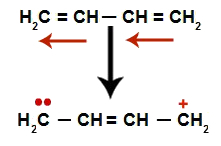
แผนผังแสดงการสั่นพ้องในอัลคาเดียนสลับกัน
โดยทั่วไปแล้ว เรามีลักษณะของพันธะคู่ระหว่างคาร์บอนที่ทั้งสองคู่เคยเป็นมาก่อนและ การสร้างตำแหน่งพันธะสองจุด โดยหนึ่งจุดบนแต่ละคาร์บอนที่ไม่ทำให้เกิดพันธะคู่อีกต่อไป (ในตัวอย่าง คาร์บอน 1 และ 4). คาร์บอน 1 และ 4 ของโซ่ได้รับ H+ และโอ้- จากน้ำ

การให้ความชุ่มชื้นบางส่วนในการสลับอัลคาเดียน
หลังจากการกำทอน พันธะ pi ของพันธะคู่ใหม่จะขาด และ H+ และโอ้- ถูกเติมเข้าไปในโมเลกุลของอัลคาเดียน OH ถูกเติมเข้าไปในคาร์บอนที่ใกล้เคียงที่สุดกับกลุ่ม OH ที่เติมครั้งแรก เนื่องจากผ่านแรงดึงดูดทางอิเล็กทรอนิกส์ของกลุ่ม ซึ่งมีอิเล็กโตรเนกาติเอตีมากกว่า

การสิ้นสุดการให้ความชุ่มชื้นในอัลคาเดียนสลับกัน
เนื่องจากการสั่นพ้อง เรากล่าวว่าอัลคาเดียนที่สลับกันได้รับความชุ่มชื้น 1.4 ทำให้เกิดไดอัลโคฮอล
→ ฉนวนอัลคาเดียน
เป็นอัลคาเดียนที่มีพันธะคู่สองพันธะซึ่งมีอะตอมอย่างน้อยห้าอะตอมพร้อมกัน ของคาร์บอน กล่าวคือ มีพันธะเดี่ยวอย่างน้อยสองพันธะที่แยกคาร์บอนที่เกี่ยวข้องกับพันธะ คู่

สูตรโครงสร้างของอัลคาเดียนที่แยกได้
ในระหว่างปฏิกิริยาไฮเดรชั่นของอัลคาเดียนที่แยกได้ พันธะ pi จะแตกออกเป็น H+ เพิ่มคาร์บอนไฮโดรเจนมากขึ้นและOH- เติมคาร์บอนที่เติมไฮโดรเจนน้อย

สมการปฏิกิริยาไฮเดรชั่นของอัลคาเดียนที่แยกได้
ดังนั้นนอกจากอัลคาเดียนที่แยกออกมาแล้ว เราจึงมีเพียงแค่ไดอัลกอฮอล์เท่านั้น
By Me. Diogo Lopes Dias
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/reacoes-hidratacao-alcadienos.htm
