จุดหลอมเหลวและจุดเดือดแสดงถึงอุณหภูมิที่สารเปลี่ยนสถานะที่ความดันที่กำหนด
ในกรณีของจุดหลอมเหลว สารจะเปลี่ยนจากสถานะของแข็งเป็นสถานะของเหลว จุดเดือดหมายถึงการเปลี่ยนแปลงจากสถานะของเหลวเป็นสถานะก๊าซ
ตัวอย่างเช่น น้ำแข็งเริ่มกลายเป็นน้ำในรูปของเหลวเมื่ออุณหภูมิเท่ากับ 0 องศาเซลเซียส ดังนั้นจุดหลอมเหลวของน้ำคือ 0 °C (ภายใต้ความดัน 1 บรรยากาศ)
หากต้องการเปลี่ยนจากของเหลวเป็นไอน้ำ น้ำต้องมีอุณหภูมิถึง 100°C ดังนั้นจุดเดือดของน้ำคือ 100 °C (ภายใต้ความดัน 1 บรรยากาศ)

จุดหลอมเหลว
เมื่อสารในสถานะของแข็งได้รับ ความร้อนมีระดับความปั่นป่วนของโมเลกุลเพิ่มขึ้น ดังนั้นอุณหภูมิของมันก็เพิ่มขึ้นเช่นกัน
เมื่อถึงอุณหภูมิที่กำหนด (จุดหลอมเหลว) การกวนของโมเลกุลจะทำลายพันธะภายในระหว่างอะตอมและโมเลกุล
เมื่อถึงจุดนี้ สารจะเริ่มเปลี่ยนสถานะและจะเข้าสู่สถานะของเหลวหากยังคงได้รับความร้อน
ในช่วง ฟิวชั่น อุณหภูมิของมันยังคงที่เนื่องจากความร้อนที่ได้รับนั้นใช้สำหรับการเปลี่ยนสถานะเท่านั้น

ความร้อนต่อหน่วยมวลที่ต้องใช้ในการเปลี่ยนเฟสเรียกว่า ความร้อนแฝง ของฟิวชั่น (Lฉ) และเป็นลักษณะของสาร
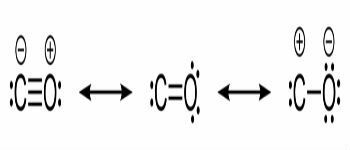
จุดหลอมเหลวและตารางความร้อนแฝง
ในตารางด้านล่าง เราระบุอุณหภูมิจุดหลอมเหลวและความร้อนแฝงของสารบางชนิดถึง ความกดอากาศ.
จุดเดือด
THE เดือด มันมีลักษณะเฉพาะโดยการเคลื่อนตัวอย่างรวดเร็วจากของเหลวไปสู่สถานะก๊าซ โดยมีการก่อตัวของไอระเหย (ฟองสบู่) ภายในของเหลว
ในการหลอมเหลว จะมีอุณหภูมิ (จุดเดือด) ซึ่งสารที่กำหนดจะเปลี่ยนจากของเหลวเป็นสถานะก๊าซ
สารจะต้องได้รับความร้อน ระหว่างการเปลี่ยนเฟสทั้งหมด อุณหภูมิจะคงที่
ความร้อนแฝงของ การทำให้กลายเป็นไอ (หลี่วี) คือปริมาณความร้อนต่อหน่วยมวลที่จำเป็นสำหรับสารในการเปลี่ยนเฟส
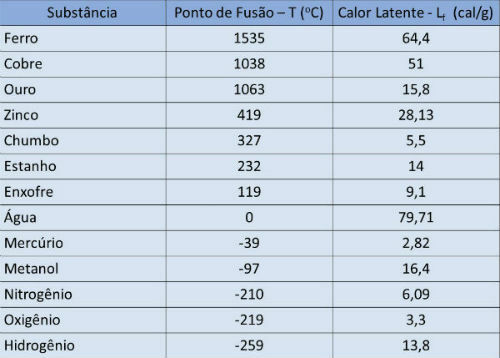
จุดเดือดและตารางความร้อนแฝง
ในตารางด้านล่าง เราระบุอุณหภูมิจุดเดือดและความร้อนแฝงของการกลายเป็นไอของสารบางชนิดที่ความดันบรรยากาศ
การรบกวนแรงดัน
อุณหภูมิของจุดหลอมเหลวและจุดเดือดขึ้นอยู่กับความดันที่กระทำต่อสาร
โดยทั่วไป สารจะมีปริมาตรเพิ่มขึ้นเมื่อเกิดการหลอมรวม ความจริงข้อนี้หมายความว่ายิ่งความดันสูงขึ้น อุณหภูมิของสารก็จะยิ่งเปลี่ยนเฟสมากขึ้นเท่านั้น
ข้อยกเว้นเกิดขึ้นกับสารบางชนิด รวมทั้งน้ำ ซึ่งจะลดปริมาตรเมื่อละลาย ในกรณีนี้ ความดันที่สูงขึ้นจะทำให้จุดหลอมเหลวต่ำลง

ความดันที่ลดลงทำให้จุดเดือดของสารที่กำหนดลดลง หมายความว่าสารจะเดือดที่อุณหภูมิต่ำกว่า
ตัวอย่างเช่น ในสถานที่ที่อยู่เหนือระดับน้ำทะเล น้ำเดือดที่อุณหภูมิต่ำกว่า 100°C เป็นผลให้การปรุงอาหารในสถานที่เหล่านี้ใช้เวลานานกว่าในสถานที่ที่ระดับน้ำทะเล
อ่านด้วย:
- การเปลี่ยนแปลงสภาพร่างกาย
- เครื่องชั่งเทอร์โมเมตริก
- เครื่องชั่งเทอร์โมเมตริก - แบบฝึกหัด
- สถานะทางกายภาพของน้ำ
- แผนภาพเฟส
- การแข็งตัว
- การควบแน่น
- คุณสมบัติ colligative
- คุณสมบัติเป็นระยะ
- การระเหย
- แบบฝึกหัดในตารางธาตุ