การระเหิดคือการเปลี่ยนแปลงจากสถานะของแข็งเป็นสถานะก๊าซและในทางกลับกันโดยไม่ผ่านสถานะของเหลว
สำหรับสารที่จะผ่านกระบวนการระเหิดนั้นจะต้องอยู่ภายใต้ค่าอุณหภูมิและความดันบางอย่าง
ลูกเหม็นและCO2 ของแข็ง (น้ำแข็งแห้ง) คือตัวอย่างของสารที่ผ่านการระเหิดภายใต้สภาวะแวดล้อม

แผนภาพเฟส
เราสามารถค้นพบสถานะทางกายภาพของสสารโดยรู้ค่าของอุณหภูมิและความดันที่สารนั้นได้รับ
สำหรับสิ่งนี้ เราใช้ไดอะแกรมที่สร้างขึ้นสำหรับแต่ละสาร จากค่าที่พบในการทดลอง
เรียกว่า "แผนภาพเฟส" มันถูกแบ่งออกเป็นสามภูมิภาคที่เป็นตัวแทนของสถานะของแข็งของเหลวและก๊าซ เส้นที่แบ่งเขตเหล่านี้ส่งสัญญาณถึงจุดที่สารเปลี่ยนเฟส
จุดสามจุดในแผนภาพแสดงอุณหภูมิและความดันที่สารสามารถอยู่ร่วมกันได้ในสามเฟส ด้านล่างจุดนี้เป็นเส้นโค้งระเหิด
จุดบนเส้นโค้งนี้จะกำหนดค่าความดันและอุณหภูมิที่จะเกิดการระเหิด
เมื่อของแข็งอยู่ภายใต้ความดันน้อยกว่าจุดสามจุด หากได้รับความร้อน ของแข็งจะผ่านเข้าสู่สถานะก๊าซโดยตรง
การเปลี่ยนแปลงจากสถานะของแข็งโดยตรงไปเป็นสถานะก๊าซสามารถเกิดขึ้นได้โดยการลดความดันเมื่ออุณหภูมิต่ำกว่าจุดสามจุด
เรียนรู้เพิ่มเติมที่: การเปลี่ยนแปลงสภาพร่างกาย.
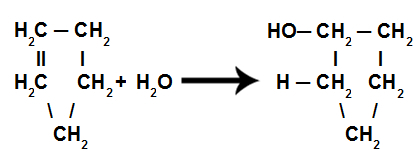
ไดอะแกรมเฟสคาร์บอนไดออกไซด์ (CO)2 )
CO จุดสามจุด2 เกิดขึ้นเมื่อความดัน 5 atm. ข้อเท็จจริงนี้เป็นข้อพิสูจน์ว่าเป็นเรื่องปกติที่จะเห็นการระเหิดในน้ำแข็งแห้ง เนื่องจากความกดอากาศแวดล้อมเท่ากับ 1 บรรยากาศ
ด้วยเหตุนี้จึงไม่ได้รับคาร์บอนไดออกไซด์เหลวภายใต้สภาวะแวดล้อม ภายใต้เงื่อนไขเหล่านี้ สถานะของแข็งหรือสถานะไอ
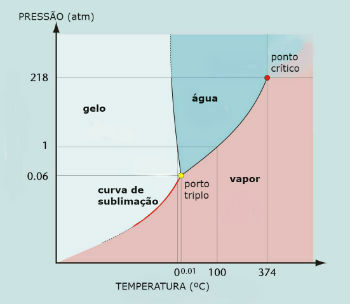
แผนภาพเฟสน้ำ (H2อ)
น้ำสามจุดเกิดขึ้นเมื่อความดันเพียง 0.06 atm ดังนั้นภายใต้สภาวะแวดล้อมจึงไม่ใช่เรื่องปกติที่น้ำจะระเหิด
หากต้องการเรียนรู้เพิ่มเติม ให้อ่านเพิ่มเติม:
- สถานะทางกายภาพของน้ำ
- สภาพทางกายภาพของสสาร
- การทำให้เป็นของเหลวหรือการควบแน่น
- คุณสมบัติของสสาร
- การแข็งตัว
- ฟิวชั่น
- การทำให้กลายเป็นไอ
- เดือด
- การระเหย