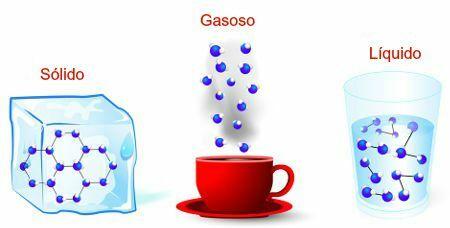
ตามที่อธิบายไว้ในข้อความ สถานะทางกายภาพของน้ำและการเปลี่ยนแปลงของน้ำการเปลี่ยนแปลงจากของแข็งเป็นของเหลวเรียกว่า ฟิวชั่น. ดังนั้นจุดหลอมเหลวคืออุณหภูมิที่สารบริสุทธิ์ที่อยู่ในสถานะของแข็งเปลี่ยนเป็นสถานะของเหลว
หากคุณนำน้ำแข็งก้อนที่อยู่ในตู้เย็นที่อุณหภูมิ -5 °C แล้วทิ้งไว้ข้างนอกในวันที่อากาศร้อน จะเกิดอะไรขึ้น? ง่าย ๆ ก้อนน้ำแข็งจะเริ่มละลาย แต่สิ่งนี้จะไม่เกิดขึ้นจนกว่าคุณจะนำออกจากตู้เย็น เนื่องจากอุณหภูมิน้ำแข็งเริ่มเพิ่มขึ้น โดยเริ่มจาก -5 ºC ถึง -4 ºC จากนั้นเป็น -3 ºC ไปเรื่อยๆ จนกระทั่งถึง 0 ºC นี่คืออุณหภูมิที่น้ำแข็งเริ่มละลาย พูดได้เลยว่า จุดหลอมเหลวหรืออุณหภูมิหลอมเหลวของน้ำแข็งเท่ากับ 0 °C (ที่ระดับน้ำทะเล)
*จำได้ว่า ºC หมายถึง องศาเซลเซียส, ซึ่งเป็นเครื่องวัดอุณหภูมิ

น้ำแข็งละลายหรือละลาย
สิ่งที่น่าสนใจที่สุดคือ อุณหภูมิยังคงอยู่ที่ค่าเดิมตลอดการเปลี่ยนแปลงสถานะทางกายภาพ ซึ่งหมายความว่า ในกรณีของน้ำแข็ง หลังจากที่ถึงจุดหลอมเหลว อุณหภูมิจะคงที่ที่ 0 °C จนกว่าน้ำแข็งทั้งหมดจะเปลี่ยนเป็นสถานะของเหลว
ซึ่งสามารถมองเห็นได้ในกราฟเช่นเดียวกับที่แสดงด้านล่าง โปรดทราบว่าอุณหภูมิยังคงเพิ่มขึ้นอย่างต่อเนื่องจนกว่าจะถึงอุณหภูมิหลอมเหลว แต่เมื่อถึงอุณหภูมินี้ อุณหภูมิจะคงที่ตลอดเวลา ก่อตัวเป็นที่ราบสูง:

กราฟจุดหลอมเหลวของน้ำแข็ง
จุดเดือดคืออุณหภูมิที่สารบริสุทธิ์เปลี่ยนจากของเหลวเป็นสถานะไอ นี่คือสิ่งที่เกิดขึ้นเมื่อเราใส่น้ำของเหลวที่ออกมาจากก๊อกลงในกองไฟ อุณหภูมิจะเพิ่มขึ้นจนถึงอุณหภูมิ 100ºC ซึ่งเป็นจุดเดือดของน้ำ (ที่ระดับน้ำทะเล)
ในรูปต่อไปนี้ คุณจะเห็นว่าเมื่อของเหลวถูกทำให้ร้อน จะเกิดความปั่นป่วนเพิ่มขึ้น ของอนุภาคซึ่งช่วยให้หลุดออกจากภาชนะและผสมกับอากาศ ฟองที่เกิดขึ้นที่อุณหภูมิเดือดคือฟองไอน้ำ
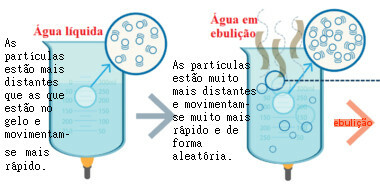
การเคลื่อนที่ของอนุภาคน้ำเดือด
ที่จุดเดือด จุดหลอมเหลวจะเกิดขึ้นเช่นเดียวกัน นั่นคือ อุณหภูมิจะยังคงอยู่ที่ค่าเดิมระหว่างการเปลี่ยนสถานะ
กราฟต่อไปนี้แสดงจุดหลอมเหลว (MP) และจุดเดือด (PE) ของน้ำ:

กราฟการเปลี่ยนแปลงสภาพน้ำที่ระดับน้ำทะเล
จุดหลอมเหลวและจุดเดือดเป็นคุณสมบัติที่สำคัญของสาร เนื่องจากแต่ละส่วนมีอุณหภูมิหลอมเหลวและอุณหภูมิเดือดจำเพาะ ไม่มีสารสองชนิดขึ้นไปที่มีจุดหลอมเหลวและจุดเดือดเท่ากัน สารที่ทราบเพียงสารเดียวที่มีจุดหลอมเหลว 0°C และจุดเดือดที่ 100°C ที่ระดับน้ำทะเลคือน้ำ
ดังนั้นปริมาณเหล่านี้จึงถูกใช้เพื่อระบุสาร ดูค่าจุดหลอมเหลวและจุดเดือดของสารอื่นๆ:

จุดหลอมเหลวและจุดเดือดของวัสดุบางชนิดที่มีอยู่ในชีวิตประจำวัน
อย่างไรก็ตาม เป็นที่น่าสังเกตว่าอุณหภูมิหลอมเหลวและการเดือดจะมีค่าคงที่ก็ต่อเมื่อสารบริสุทธิ์เท่านั้น ในกรณีของสารผสม ค่าเหล่านี้จะแตกต่างกันไป กล่าวคือ เดือดที่อุณหภูมิหนึ่งและจบลงด้วยการเปลี่ยนสถานะทางกายภาพที่อีกอุณหภูมิหนึ่ง ดังนั้น กราฟของการเปลี่ยนแปลงในสถานะทางกายภาพของสารผสมจึงไม่มีขีดจำกัดคงที่สองจุดดังกล่าวสำหรับจุดหลอมเหลวและสำหรับจุดเดือด
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี