เมื่อสารละลายสองชนิดผสมกัน ไม่ว่าจะต่างกันหรือไม่ จำเป็นต้องวิเคราะห์ก่อนว่ามีปฏิกิริยาระหว่างสารละลายทั้งสองหรือไม่ ตัวอย่างเช่น ถ้าเราผสมสารละลายน้ำกับน้ำตาล (สารละลายซูโครสในน้ำ) กับสารละลายน้ำกับเกลือ (น้ำเกลือ) เราจะได้ การผสมสารละลายที่ไม่มีปฏิกิริยาเคมี
สิ่งเดียวกันนี้จะเกิดขึ้นหากเราผสมสารละลายโซเดียมคลอไรด์ (NaCl) สองสารละลายที่มีความเข้มข้นต่างกัน ในกรณีนี้ก็จะไม่เกิดปฏิกิริยาเช่นกัน จากนั้นเราสามารถนิยามตัวอย่างนี้เป็น a การผสมสารละลายของตัวถูกละลายชนิดเดียวกันโดยไม่มีปฏิกิริยาเคมีใดๆโดยที่ตัวอย่างแรกคือ a การผสมสารละลายของตัวถูกละลายต่าง ๆ โดยไม่มีปฏิกิริยาเคมี
ในทั้งสองกรณี ส่วนประกอบทางเคมีของสารละลายจะไม่เปลี่ยนแปลงอย่างไรก็ตาม แง่มุมเชิงปริมาณบางอย่างจะต้องได้รับการคำนวณใหม่
เพื่อให้เข้าใจว่าเราสามารถกำหนดความเข้มข้นของโมลาร์ (โมลาริตี) และความเข้มข้นทั่วไปของส่วนผสมของสารละลายโดยไม่มีปฏิกิริยาได้อย่างไร มาดูวิธีแก้ปัญหาของสองกรณีที่กล่าวถึง:
1) ส่วนผสมของสารละลายของตัวถูกละลายชนิดเดียวกันโดยไม่เกิดปฏิกิริยาเคมี:

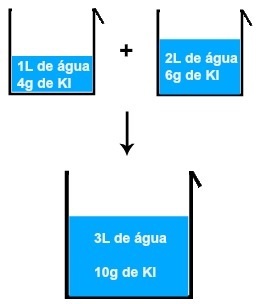
ลองนึกภาพว่าเราผสมสารละลายโซเดียมคลอไรด์สองชนิด สารละลายหนึ่งมีความเข้มข้น 2.0 กรัม/ลิตรในสารละลาย 60.0 มล. และอีกสารละลายหนึ่งมี 2.5 กรัม/ลิตรในปริมาตรของสารละลาย 80 มล.
เนื่องจากไม่มีปฏิกิริยาเกิดขึ้น ทั้งมวลและปริมาตรจึงเป็นเพียงผลรวมของมวลและปริมาตรตั้งต้นเท่านั้น:
m (สารละลาย) = m1 (NaCl) + ม2 (NaCl)
ม1 (NaCl) = ว. C m2 (NaCl) = ว. ค
ม1 (NaCl) = 0.06L. 2.0g/L m2 (NaCl) = 0.08L. 2.5 กรัม/ลิตร
ม1 (NaCl) =0.1 กรัม2 (NaCl) =0.2 ก.
ม. (สารละลาย) = 0.1 ก. + 0.2 ก.
ม. (สารละลาย) =0.3 ก.
v (สารละลาย) = v1 (NaCl) + v2 (NaCl)
v (สารละลาย) = (60 + 80) มล.
v (สารละลาย) =140 mL = 0.14 L
ความเข้มข้นสามารถรับได้โดยใช้ข้อมูลเหล่านี้:
C (สารละลาย) = เมตร (สารละลาย)
วี (โซลูชั่น)
C (สารละลาย) = 0.3 กรัม
0.14L
ค (สารละลาย)≈ 2.14 ก./ลิตร
2) ส่วนผสมของสารละลายของตัวถูกละลายต่างกันโดยไม่เกิดปฏิกิริยาเคมี:
ยกตัวอย่างเช่น ส่วนผสมระหว่าง 500 มล. ของสารละลายซูโครสในน้ำ (C12โฮ22โอ11) ซึ่งเริ่มแรกมีความเข้มข้น 18.0 กรัม/ลิตร กับสารละลายน้ำเกลือ 1 ลิตร (สารละลายโซเดียมคลอไรด์ – NaCl) ที่มีความเข้มข้น 100.0 กรัม/ลิตร
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
หลังจากผสมแล้ว โมลาริตี ความเข้มข้นร่วม มวล และปริมาตรของสารละลายที่เกิดจากส่วนผสมกลายเป็นอะไร
เนื่องจากไม่มีปฏิกิริยาเคมี มวลของ C12โฮ22โอ11 และ NaCl ยังคงไม่เปลี่ยนแปลง และค่ามวลเริ่มต้นสามารถทำได้โดยกฎง่ายๆ สามข้อโดยใช้ความเข้มข้นของปฏิกิริยา
18.0 ก. 1 ลิตร
ม. (C12H22O11) 0.5L
ม. (C12โฮ22โอ11) = 9.0 ก.
ม. (NaCl) 100.0 ก
มวลสามารถทำได้โดยสูตร:
ม = วี ค
ม. (C12โฮ22โอ11) = 0.5 ลิตร 18g/L
ม. (C12โฮ22โอ11) = 9.0 ก.
ม. (NaCl) = 1 ลิตร 100.0 กรัม/ลิตร
ม. (NaCl) = 100.0 ก.
ดังนั้น มวลรวมของสารละลายคือผลรวมของมวลทั้งสอง:
ม. (สารละลาย) = ม. (C12โฮ22โอ11) + ม. (NaCl)
m (สารละลาย) = 109.0 g
ปริมาณเป็นเพียงผลรวมของปริมาณเริ่มต้น ดังนั้นเราจึงมี:
v (คำตอบสุดท้าย) = v (C12โฮ22โอ11) + วี (NaCl)
v (คำตอบสุดท้าย) = (0.5 + 1)L
v (ทางออกสุดท้าย) = 1.5L
ความเข้มข้นขั้นสุดท้ายทำได้โดยการคำนวณความเข้มข้นของตัวถูกละลายแต่ละตัวแยกกัน เนื่องจากพวกมันไม่ทำปฏิกิริยาซึ่งกันและกันและมวลของพวกมันไม่เปลี่ยนแปลง เราสามารถใช้สูตรความเข้มข้นต่อไปนี้:
ค = ม
วี
เริ่มต้น = mเริ่มต้น สุดท้าย c = mสุดท้าย
วีเริ่มต้น วีสุดท้าย
มเริ่มต้น = มสุดท้าย
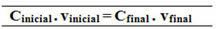
ซี (C12โฮ22โอ11) =?
คเริ่มต้น. วีเริ่มต้น = Cสุดท้าย. วีสุดท้าย
18.0 กรัม/ลิตร 0.5 ลิตร = Cสุดท้าย .1.5 ลิตร
ซี (C12โฮ22โอ11) สุดท้าย = 6.0 กรัม/ลิตร
C(NaCl)=?
คเริ่มต้น. วีเริ่มต้น = Cสุดท้าย. วีสุดท้าย
100.0 กรัม/ลิตร 1 L = Cfinal .1.5 L
ซี (NaCl)สุดท้าย = 66.67 ก./ลิตร
ความสัมพันธ์ที่ทำขึ้นสำหรับสูตรความเข้มข้นร่วมนี้สามารถคำนวณหาโมลาริตี (Mผม. วีผม = เอ็มฉ. วีฉ) และสำหรับความเข้มข้นในมวลโดยมวล (หัวข้อ - Tผม. วีผม = Tฉ. วีฉ).
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี