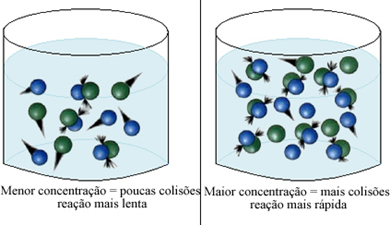
เราสามารถสังเกตได้ว่า เมื่อใดก็ตามที่เราเพิ่มความเข้มข้นของสารตั้งต้นหนึ่งหรือทั้งหมดที่มีส่วนร่วมในปฏิกิริยาเคมี จะมีอัตราการพัฒนาเพิ่มขึ้น นั่นคือความเร็วของปฏิกิริยา
ตรงกันข้ามก็เป็นจริง ตัวอย่างเช่น ในปัจจุบันมีการแนะนำให้เราใช้เจลแอลกอฮอล์แทนแอลกอฮอล์ทั่วไป เนื่องจากมีความเสี่ยงที่จะเกิดการลุกไหม้น้อยกว่าและหลีกเลี่ยงอุบัติเหตุได้ แอลกอฮอล์เหลวธรรมดาจริง ๆ แล้วเป็นส่วนผสมของแอลกอฮอล์และน้ำ โดยแอลกอฮอล์เจลที่มีแอลกอฮอล์ในปริมาณที่น้อยกว่า ดังนั้น เมื่อความเข้มข้นของสารตั้งต้นการเผาไหม้ตัวใดตัวหนึ่งลดลง ในกรณีของแอลกอฮอล์ ปฏิกิริยาจะดำเนินไปช้ากว่า ในทางกลับกัน ยิ่งแอลกอฮอล์บริสุทธิ์มากเท่าไร ปฏิกิริยาการเผาไหม้ก็จะยิ่งเร็วขึ้น

ตามที่ระบุในข้อความ เงื่อนไขการเกิดปฏิกิริยาเคมีเงื่อนไขหนึ่งของปฏิกิริยาที่จะเกิดขึ้นคือ การชนกันอย่างมีประสิทธิภาพ ระหว่างอนุภาค ดังนั้น การเพิ่มขึ้นของความเข้มข้นของรีเอเจนต์ทำให้สามารถมีอนุภาคหรือโมเลกุลจำนวนมากขึ้นในพื้นที่เดียวกันได้ สิ่งนี้จะเพิ่มจำนวนการชนกันระหว่างพวกเขาและยังเพิ่มโอกาสที่การชนกันอย่างมีประสิทธิภาพจะเกิดขึ้นซึ่งจะส่งผลให้เกิดปฏิกิริยาเกิดขึ้น ผลที่ได้คือปฏิกิริยาเกิดขึ้นเร็วขึ้น
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
หากต้องการดูสิ่งนี้ ให้นึกถึงตัวอย่างต่อไปนี้: เมื่อเรามีถ่านที่คุอยู่และเราต้องการให้การเผาไหม้นี้ดำเนินการเร็วขึ้น เราจะเป่าหรือเป่าถ่านที่คุ ทำไมสิ่งนี้ถึงใช้งานได้?
หนึ่งในสารตั้งต้นในปฏิกิริยาการเผาไหม้นี้คือออกซิเจนในอากาศ เมื่อเราเขย่า กระแสลมจะขจัดเถ้าที่เกิดขึ้นระหว่างการเผาไหม้และทำให้ออกซิเจนสัมผัสกับถ่านได้ง่ายขึ้น ด้วยวิธีนี้ เราเพิ่มการสัมผัสระหว่างสารตั้งต้นและเร่งปฏิกิริยาการเผาไหม้
สั้น ๆ เรามี:

เมื่อทำงานกับก๊าซ วิธีหนึ่งที่จะเพิ่มความเข้มข้นของสารตั้งต้นคือ ลดความดัน. เมื่อเราทำสิ่งนี้ เราจะลดปริมาตรและทำให้ความเข้มข้นของตัวทำปฏิกิริยาเพิ่มขึ้น

โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ความเข้มข้นของรีเอเจนต์และความเร็วของปฏิกิริยา"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.



