ไนเตรตเป็นสารประกอบอนินทรีย์ที่มีประจุลบNO3-.
ไนโตรเจนมาจากตระกูล 15 มีอิเล็กตรอน 5 ตัวในเปลือกเวเลนซ์และจำเป็นต้องสร้างพันธะโควาเลนต์สามตัว (ร่วมกับอิเล็กตรอนร่วมกัน) ให้มีอิเล็กตรอนแปดตัวในเปลือกเวเลนซ์จึงคงอยู่ มั่นคง อย่างไรก็ตาม ออกซิเจนแต่ละตัวมีอิเล็กตรอน 6 ตัวในเปลือกสุดท้าย ดังนั้นแต่ละอะตอมจึงต้องสร้างพันธะสองพันธะเพื่อให้มีความเสถียร
ดังนั้น ในไอออนไนเตรต ไนโตรเจนเป็นองค์ประกอบกลาง ซึ่งทำให้เกิดพันธะคู่กับออกซิเจนตัวใดตัวหนึ่ง ซึ่งมีความเสถียร เป็นพันธะเดี่ยวกับออกซิเจนอีกสองตัวหนึ่ง และอีกพันธะหนึ่งเป็นพันธะโควาเลนต์ ข้อมูล ซึ่งหมายความว่าออกซิเจนตัวใดตัวหนึ่งไม่เสถียร ต้องรับอิเล็กตรอนเพิ่มอีก 1 ตัว ทำให้มีประจุทั้งหมดเท่ากับ -1 ด้วยไนโตรเจนเดทีฟไนโตรเจนทำให้เกิดพันธะมากกว่าที่จะทำได้ โดยบริจาคอิเล็กตรอนหนึ่งตัว ได้ประจุเท่ากับ +1 ดูโครงสร้างด้านล่างของประจุลบนี้:
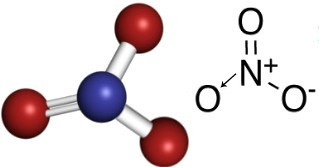
ประจุลบนี้สามารถรับอิเล็กตรอนและสร้างสารประกอบที่เป็นกลางทางไฟฟ้า เกลืออนินทรีย์ สารประกอบเหล่านี้ล้วนละลายได้ในน้ำ
การใช้งานหลักของไนเตรตอยู่ในยา เช่น ยาขยายหลอดเลือดในการรักษาโรคหลอดเลือดหัวใจตีบ (ความเจ็บปวดใน เกิดจากปริมาณออกซิเจนต่ำโดยการไหลเวียนของเลือดไปยังกล้ามเนื้อหัวใจ) และภาวะหย่อนสมรรถภาพทางเพศ ชาย. พวกเขายังใช้ในปุ๋ยและวัตถุระเบิดดังที่จะกล่าวถึงในภายหลัง
ไนเตรตสามารถผลิตได้จากปฏิกิริยาการทำให้เป็นกลางของกรดไนตริก (HNO)3) ด้วยพื้นฐานบางอย่าง ดูตัวอย่างด้านล่าง ที่เกิดแมกนีเซียมไนเตรต:
HNO3 + มก. (OH)2 → มก. (NO3)2+ โฮ2โอ
สามตัวอย่างหลักของสารประกอบประเภทนี้คือ โซเดียมไนเตรต (NaNO3), โพแทสเซียมไนเตรต (KNO3) และแอมโมเนียมไนเตรต (NH4ที่3). ในทุกกรณีเหล่านี้ ไพเพอร์ (Na+,K+ และ NH4+) ให้อิเล็กตรอน 1 ตัวสำหรับไอออนไนเตรต แต่ในความเป็นจริง ประจุที่ตรงข้ามกันเหล่านี้จะดึงดูดกันและก่อตัวเป็นกระจุกไอออนิกที่ชัดเจน ซึ่งก็คือโครงผลึกคริสตัล ดังนั้น ไนเตรตมักจะเป็นของแข็งผลึก ดังที่แสดงด้านล่างในกรณีของโซเดียมไนเตรต:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
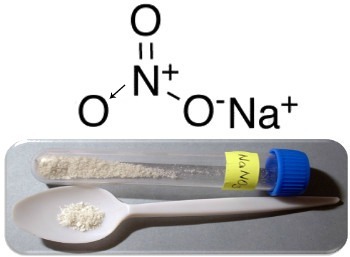
สารประกอบนี้ใช้ในการผลิตปุ๋ย แต่ส่วนใหญ่รู้จักกันในชื่อ ดินประสิวชิลีเนื่องจากมีเงินฝากจำนวนมากในทะเลทรายชิลี มันถูกเปลี่ยนเป็นโพแทสเซียมไนเตรตซึ่งใช้ทำผงสีดำที่ใช้ในอาวุธและวัตถุระเบิดต่างๆ

ทั้งโซเดียมไนเตรตและโพแทสเซียมไนเตรตเรียกว่า "เกลือแร่" ซึ่งใช้กันอย่างแพร่หลายเช่น สารกันบูดของสีของเนื้อกระป๋องและเนื้อรมควันเช่นเดียวกับในอาหารบางชนิดเพื่อให้รู้สึกดีขึ้น ความอิ่ม อย่างไรก็ตาม การบริโภคทำให้เกิดความเสียหายอย่างร้ายแรงต่อสุขภาพ เนื่องจากไนเตรตเหล่านี้สามารถเปลี่ยนแปลงได้โดยแบคทีเรียจาก กลายเป็นไนไตรต์และต่อมากลายเป็นไนโตรซามีนซึ่งเป็นสารก่อมะเร็งซึ่งส่วนใหญ่ก่อให้เกิดมะเร็งใน ท้อง. ไนไตรต์ยังเปลี่ยนฮีโมโกลบินในเลือด ทำให้ไม่สามารถขนส่งออกซิเจนได้
สาเหตุหลักของการบริโภคไนเตรตมากเกินไปคือการใช้ปุ๋ยไนโตรเจนในการเพาะปลูกผัก
ดินประสิวยังเป็นอันตรายเพราะเพิ่มความเข้มข้นของโซเดียมไอออนในร่างกายซึ่งอาจทำให้เกิดปัญหาหัวใจเช่นความดันโลหิตสูง
โอ แอมโมเนียมไนเตรต มันยังใช้เป็นปุ๋ยและระเบิด และยังใช้กับน้ำมันเชื้อเพลิงในการโจมตีของผู้ก่อการร้ายในอาคารเวิลด์เทรดเซ็นเตอร์เมื่อวันที่ 11 กันยายน พ.ศ. 2544

การโจมตี World Trade Center ใช้แอมโมเนียมไนเตรต*
* ลิขสิทธิ์ภาพ: Dan Howell และ Shutterstock.com
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ไนเตรต"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/nitratos.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.
เคมี

เกลือในชีวิตประจำวัน แคลเซียมคาร์บอเนต โซเดียมคลอไรด์ โซเดียมฟลูออไรด์ โพแทสเซียมไนเตรต โซเดียมไนเตรต โซเดียม, โซเดียมคาร์บอเนต, โซเดียมไบคาร์บอเนต, โซเดียมไบคาร์บอเนต, โซเดียมซัลไฟต์, ดินประสิว, โซดา.