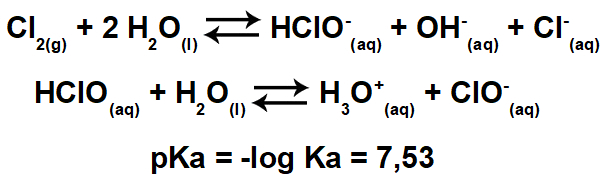ที่ แรงระหว่างโมเลกุล พวกมันคือแรงดึงดูดของไฟฟ้าสถิตซึ่งมีหน้าที่ในการรวมโมเลกุล (สารประกอบโมเลกุล) ทำให้พวกมันอยู่ในสถานะของแข็งหรือของเหลว มีความสำคัญอย่างยิ่งเนื่องจากเป็นตัวกำหนดคุณสมบัติทางกายภาพทั้งหมด (จุดหลอมเหลว จุดเดือด ความหนาแน่นและความสามารถในการละลาย) ของสาร
ในบทนี้เราจะศึกษาเรื่อง ความสัมพันธ์ระหว่างแรงระหว่างโมเลกุลกับจุดเดือดของสาร. เริ่มแรก ให้ระลึกถึงแรงระหว่างโมเลกุลที่สำคัญสามประเภท ได้แก่ :
♦ ไดโพลไดโพล: คือแรงที่เกิดขึ้นในโมเลกุลขั้ว เนื่องจากโมเลกุลเหล่านี้มีขั้วบวกและขั้วลบ แรงไดโพล-ไดโพลจึงขึ้นอยู่กับแรงดึงดูดระหว่างปลายขั้วบวกของโมเลกุลหนึ่งกับปลายขั้วลบของอีกขั้วหนึ่ง ตัวอย่าง: HCl, HBr, SO2 และ PH3
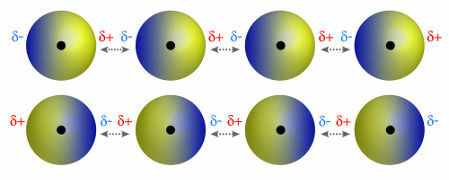
โมเลกุลที่มีขั้วบวกและขั้วลบดึงดูดกัน
♦ ไดโพลเหนี่ยวนำ: คือแรงระหว่างโมเลกุลที่เกิดขึ้นเฉพาะในโมเลกุลไม่มีขั้ว (ไม่มีขั้ว) เมื่อโมเลกุลขั้วสองขั้วเข้าใกล้ จะเกิดการเสียรูปชั่วขณะของเมฆของพวกมัน อิเล็กตรอนซึ่งทำให้เกิดความไม่สมดุลในอิเล็กตรอนของโมเลกุลซึ่งกระจายอยู่ในa แตกต่างสำหรับเธอ ในขณะนั้น ไดโพลชั่วขณะจะถูกสร้างขึ้น และโมเลกุลจะมีขั้วบวกและขั้วลบชั่วขณะ ซึ่งทำให้เกิดแรงดึงดูด ตัวอย่าง: CO2, CH4 และ BH3
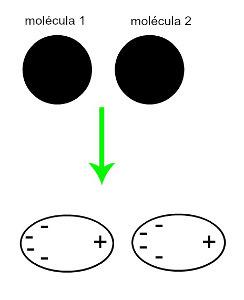
การประมาณของโมเลกุลไม่มีขั้วสองโมเลกุลทำให้เกิดการเสียรูปและส่งผลให้มีการกระจายอิเล็กตรอนซึ่งก่อให้เกิดไดโพลชั่วขณะ
♦ พันธะไฮโดรเจน: เป็นแรงระหว่างโมเลกุลที่เกิดขึ้นในโมเลกุลมีขั้ว แต่เฉพาะในแรงที่มีอะตอมไฮโดรเจนที่ถูกบังคับพันธะโดยตรงกับฟลูออรีน ออกซิเจน หรืออะตอมไนโตรเจน ถือได้ว่าเป็นแรงไดโพล-ไดโพล แต่มีความรุนแรงมากกว่ามาก ปฏิสัมพันธ์มักเกิดขึ้นระหว่างไฮโดรเจนของโมเลกุลหนึ่งกับอะตอมที่แตกต่างกัน (F, O, N) ของอีกโมเลกุลหนึ่ง ตัวอย่าง: H2O, NH3 และ HF
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
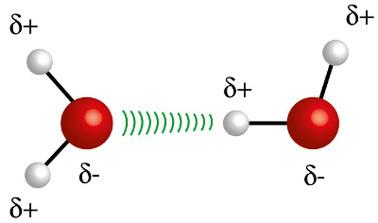
อะตอมไฮโดรเจน (ทรงกลมสีขาว) ของโมเลกุลหนึ่งทำปฏิกิริยากับออกซิเจน (ทรงกลมสีแดง) ของโมเลกุลน้ำอื่น
เมื่อจำแรงระหว่างโมเลกุลทั้งสามได้แล้ว เราก็สามารถเชื่อมโยงพวกมันกับจุดเดือดของสารได้ ถูกเรียก จุดเดือด อุณหภูมิที่โมเลกุลของสารที่กำหนดหยุดอยู่ในสถานะของเหลว (มีแรงระหว่างโมเลกุลแตก) และเปลี่ยนเป็นสถานะก๊าซ รายละเอียดที่น่าสนใจคือ แรงระหว่างโมเลกุลและจุดเดือด ของสารมีความสัมพันธ์ที่เข้มข้นและโดยตรง เนื่องจากยิ่งแรงระหว่างโมเลกุลรุนแรงมากเท่าใด จุดเดือดก็จะยิ่งสูงขึ้น ลำดับความเข้มของแรงระหว่างโมเลกุลคือ:
ไดโพลเหนี่ยวนำ < ไดโพล-ไดโพล < พันธะไฮโดรเจน
ดังนั้น เราสามารถสรุปได้ว่าโมเลกุลที่มีพันธะไฮโดรเจนเป็นแรงปฏิสัมพันธ์มีจุดเดือดที่สูงกว่าโมเลกุลที่มีไดโพล-ไดโพล เป็นต้น ตารางด้านล่างแสดงสารสามชนิดและค่าจุดเดือด:
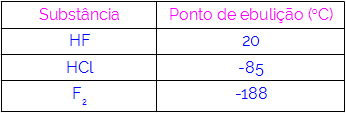
เราสังเกตในตารางว่า HF มีจุดเดือดสูงกว่าเนื่องจากโมเลกุลของมันถูกเชื่อมด้วยพันธะไฮโดรเจน สาร F2 มันมีจุดเดือดต่ำสุด เนื่องจากโมเลกุลของมันถูกดึงดูดโดยไดโพลที่ถูกเหนี่ยวนำ
By Me. Diogo Lopes Dias
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "แรงระหว่างโมเลกุลและจุดเดือดของสาร"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.
เคมี
สารโมเลกุล อุณหภูมิเดือด พื้นผิวสัมผัส จุดเดือด แรงดึงดูดระหว่างโมเลกุล พันธะเคมี สารประกอบโมเลกุล พันธะเคมีโควาเลนต์ พันธะไอออนิก พันธะโลหะ สถานะทางกายภาพของ แย่