กฎของเฮสส์ถูกสร้างขึ้นโดยนักเคมีชาวสวิส Germain H. เฮสส์ (1802-1850) ซึ่งถือเป็นหนึ่งในผู้ก่อตั้งเทอร์โมเคมี กฎหมายของเขากล่าวว่า:

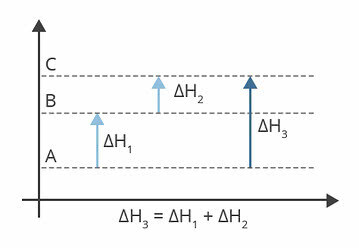
นั่นคือ ΔH ขึ้นอยู่กับค่าเอนทาลปีของรีเอเจนต์และผลิตภัณฑ์เท่านั้น ดังในนิพจน์:
| ΔH = ΔHรีเอเจนต์ + ΔHสินค้า |
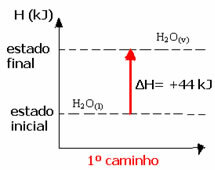
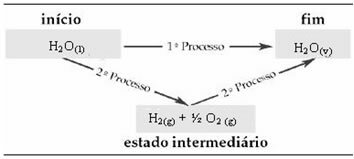
ตัวอย่างเช่น พิจารณาปฏิกิริยาที่น้ำ 1 โมล (H2O) เปลี่ยนเป็นน้ำในสถานะก๊าซ ปฏิกิริยานี้เกิดขึ้นสองครั้ง อย่างไรก็ตาม มีการเลือกเส้นทางที่แตกต่างกัน:
(๑) ดำเนินการในขั้นตอนเดียว:
โฮ2โอ(1) → ฮ2โอ(v) ΔH= +44 kJ
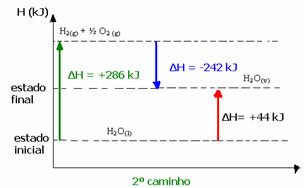
(2nd) ดำเนินการในสองขั้นตอน:
ขั้นตอนที่ 1: H2โอ(1) → ฮ2(ก.) + ½2 (ก.) ΔH= +286 kJ
ขั้นตอนที่ 2: H2(ก.) + ½2 (ก.) → ฮ2โอ(v) ΔH= -242 kJ
โฮ2โอ(1) → ฮ2โอ(v) ΔH= +44 kJ
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
โปรดทราบว่าไม่ว่าจะดำเนินการหนึ่งหรือสองขั้นตอนหรือไม่ การเปลี่ยนแปลงเอนทาลปี (ΔH) จะอยู่ที่ 44 kJ เสมอ เนื่องจาก ΔH คือผลรวมเชิงพีชคณิตของค่า valoresH ของขั้นตอนที่ประกอบเป็นกระบวนการ กล่าวคือ ของกระบวนการระดับกลาง:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
ตัวอย่างเช่น ในกรณีที่สอง ผลรวม ΔH ของปฏิกิริยาคือผลรวมของ ΔH ของขั้นตอนแรก (ΔH= +286 kJ) กับของวินาที (ΔH= -242 kJ) ดังนั้นเราจึงได้ค่าปฏิกิริยาเดียวกันในขั้นตอนเดียว:
ΔH = (+286 + (-242)) kJ
ΔH = (+286 -242) กิโลจูล
ΔH = +44 kJ
ดังนั้นเราจึงสนใจเฉพาะค่าเริ่มต้นและค่าสุดท้ายเท่านั้น ในกรณีนี้ สถานะเริ่มต้นจะสอดคล้องกับ H2โอ(1) และสิ้นสุดที่H2โอ(v).
กฎข้อนี้มีความสำคัญมากในเทอร์โมเคมี เนื่องจากปฏิกิริยาเคมีบางอย่างไม่สามารถกำหนด ΔH ได้ในการทดลอง อย่างไรก็ตาม ตามกฎของเฮสส์ เอนทาลปีของปฏิกิริยาประเภทนี้สามารถคำนวณได้จากเอนทาลปีของปฏิกิริยาอื่นๆ (ปฏิกิริยาระดับกลาง)
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "กฎของเฮสส์"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/lei-hess.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.