แบตเตอรี่ เป็นระบบที่พลังงานเคมีถูกแปลงเป็นพลังงานไฟฟ้าโดยธรรมชาติ
ในปี 1836 นักเคมีและนักอุตุนิยมวิทยาชาวอังกฤษ John Frederic Daniell (1790-1845) ได้สร้างกองที่แตกต่างจากที่รู้จักในขณะนั้น นั่นคือกอง Alessandro Volta ในกองนี้เขา เชื่อมต่ออิเล็กโทรดสองขั้วซึ่งเป็นระบบที่ประกอบด้วยโลหะที่แช่อยู่ในสารละลายที่เป็นน้ำของเกลือที่เกิดจากไอออนบวกของโลหะนี้.
อิเล็กโทรดชนิดหนึ่ง คือ อิเล็กโทรดทองแดง ประกอบด้วยแผ่นทองแดงจุ่มลงในสารละลายของคอปเปอร์ซัลเฟต (CuSO4) อิเล็กโทรดอีกอันคืออิเล็กโทรดสังกะสี ซึ่งประกอบด้วยแผ่นสังกะสีที่แช่ในสารละลายซิงค์ซัลเฟต (ZnSO4)
อิเล็กโทรดทั้งสองนี้เชื่อมต่อกันด้วยวงจรไฟฟ้าที่มีหลอดไฟ เพราะหากเปิดขึ้นก็จะบ่งบอกถึงการเกิดขึ้นของกระแสไฟฟ้า
นอกจากนี้ยังมีสะพานเกลือระหว่างพวกเขา สะพานนี้ประกอบด้วยหลอดแก้วรูปตัว U ที่มีสารละลายเข้มข้นของเกลือที่ละลายน้ำได้สูง เช่น โพแทสเซียมคลอไรด์ (KCl (aq)) เป็นต้น ปลายหลอดเคลือบด้วยสำลีหรือวุ้น
ด้านล่างมีโครงสร้างของเซลล์นี้หรือเซลล์ไฟฟ้าเคมี ซึ่งกลายเป็นที่รู้จักในชื่อเซลล์แดเนียล จำได้ว่าแต่ละอิเล็กโทรดเรียกว่าครึ่งเซลล์
เมื่อปิดวงจรไฟจะเปิดขึ้นและหลังจากนั้นครู่หนึ่ง
แผ่นสังกะสีสึกกร่อนและมีมวลลดลง ในขณะที่แผ่นทองแดงอยู่ตรงข้าม มวลของสังกะสีจะเพิ่มขึ้น (ดังแสดงในรูปด้านล่าง). นอกจากนี้ยังตั้งข้อสังเกตว่า มีการเพิ่มขึ้นของความเข้มข้นในโมล/ลิตรของไอออน Zn2+ และไอออน Cu ลดลง2+.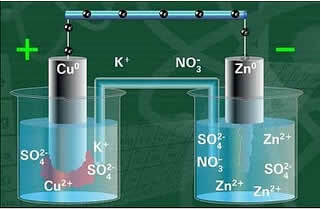
แผนผังสแต็กของแดเนียล
ทำไมสิ่งนี้ถึงเกิดขึ้น?
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
เพื่อให้เข้าใจ มาดูปฏิกิริยาที่เกิดขึ้นที่อิเล็กโทรดแยกกัน
ในอิเล็กโทรดสังกะสีจะเกิดปฏิกิริยาสมดุลต่อไปนี้:
สังกะสี ↔ Zn2+(ที่นี่) + 2 และ-
ซึ่งหมายความว่าโลหะสังกะสี (จากจาน) ผ่านการเกิดออกซิเดชัน กล่าวคือ สังกะสีจะบริจาคอิเล็กตรอน 2 ตัวให้กับสังกะสีไอออนบวก (จากสารละลาย) และกลายเป็น Zn2+ ในทางกลับกัน สังกะสีไอออนบวกที่มีอยู่ในสารละลายจะได้รับอิเล็กตรอนสองตัวที่ได้รับบริจาคจากสังกะสีและกลายเป็นสังกะสีที่เป็นโลหะ จึงมีกระบวนการออกซิเดชั่นและรีดักชันอย่างต่อเนื่อง
เช่นเดียวกับอิเล็กโทรดทองแดงซึ่งจะมีปฏิกิริยาทั่วโลกในสมดุลไดนามิก: Cu(s) ↔ Cu2+(ที่นี่) + 2 และ-
แดเนียลตระหนักว่าถ้าเขาเชื่อมต่ออิเล็กโทรดทั้งสองนี้ ยิ่งอิเล็กโทรดที่มีปฏิกิริยามากขึ้นจะบริจาคอิเล็กตรอนให้กับไอออนบวกที่มีปฏิกิริยาน้อยกว่าแทนที่จะทำเช่นนี้กับไพเพอร์ในสารละลายของตัวเอง ในกรณีนี้ สังกะสีจะมีปฏิกิริยามากที่สุดและเกิดปฏิกิริยาออกซิเดชัน โดยให้อิเล็กตรอนกับทองแดง จึงทำให้มวลของสังกะสีลดลง อิเล็กโทรดที่ผ่านการออกซิเดชันคือขั้วลบที่เรียกว่าแอโนด อิเล็กโทรดทองแดงเป็นอิเล็กโทรดที่ผ่านการรีดิวซ์ ไอออนบวกของทองแดงรับอิเล็กตรอนสองตัวจากสังกะสี และเรียกว่าแคโทด (ขั้วบวก)
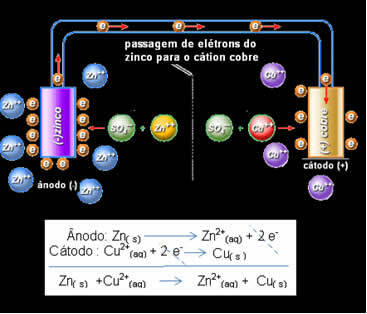
ทางอิเล็กตรอนและสมการโกลบอลของแดเนียล
ด้านบนเรามีสมการสากลสำหรับสแต็กนี้ ซึ่งได้มาจากการเพิ่มครึ่งปฏิกิริยาทั้งสอง การแสดงแทนหรือสัญกรณ์เคมีทำขึ้นตามกฎต่อไปนี้:

ดังนั้นสำหรับสแต็คของ Daniell เรามี:
Zn / Zn2+//ตูด2+ / ตูด
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ทีมโรงเรียนบราซิล
เคมีฟิสิกส์ - เคมี - โรงเรียนบราซิล
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "กองของแดเนียล"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.