THE การก่อตัวเอนทาลปีเรียกอีกอย่างว่า เอนทาลปีมาตรฐานของการก่อตัว, หรือ ความร้อนมาตรฐานของการก่อตัวคือการคำนวณความร้อนที่ปล่อยออกมาหรือดูดซับในการก่อตัวของสาร 1 โมลจากสารธรรมดาในสภาวะมาตรฐาน
เป็นไปไม่ได้ที่จะคำนวณค่าสัมบูรณ์ของเอนทาลปีของสารแต่ละชนิด แต่สามารถคำนวณความแปรผันของเอนทาลปีที่เกิดขึ้นในปฏิกิริยาโดยใช้เครื่องวัดปริมาณความร้อน
ต้องจำไว้ว่า มีการตกลงที่จะใช้ค่าเอนทาลปีเท่ากับศูนย์สำหรับสารธรรมดาในสถานะมาตรฐาน. ดังนั้น หากเราต้องการค้นหาว่าเอนทาลปีของการก่อตัวของสารคืออะไร เราจำเป็นต้องรู้ค่าของเอนทาลปีของปฏิกิริยาการก่อตัวจากสารธรรมดาเท่านั้น
ตัวอย่างเช่น เราต้องการหาเอนทาลปีของน้ำ 18 กรัม ซึ่งเท่ากับ 1 โมล เนื่องจากมวลโมลาร์ของมันคือ 18 กรัม/โมล ในการทำเช่นนี้ ก่อนอื่นเราต้องทำปฏิกิริยาเพื่อสร้างน้ำจากสารธรรมดาดังที่แสดงด้านล่าง:
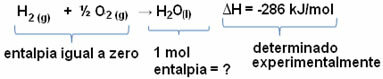
โปรดทราบว่าค่าของการเปลี่ยนแปลงเอนทาลปีที่เกิดขึ้นในปฏิกิริยานี้ถูกกำหนดโดยการทดลองโดยใช้เครื่องวัดความร้อนและมีค่าเท่ากับ -286 kJ/mol
สูตรที่คำนวณการเปลี่ยนแปลงเอนทัลปี (ΔH) คือ:
ΔH = Hสินค้า - โฮรีเอเจนต์
ดังนั้น เนื่องจากเราทราบค่าของ ΔH และเอนทาลปีของสารตั้งต้นมีค่าเท่ากับศูนย์ (เนื่องจากเป็นสารธรรมดาในสถานะมาตรฐาน) เราจึงสามารถสรุปได้ ว่าค่าเอนทาลปีของน้ำ 1 โมล เท่ากับการเปลี่ยนแปลงเอนทาลปีของปฏิกิริยาชั้นหิน เนื่องจากเป็นผลิตภัณฑ์เดียวของปฏิกิริยานั้น ดังรูป ร้อง:
ΔH = Hสินค้า - โฮรีเอเจนต์
-286 kJ/โมล = HH2O - (โฮH2 + โฮ1/2 โอ2)
-286 kJ/โมล = HH2O - 0
โฮH2O = - 286 กิโลจูล/โมล
เอนทาลปีประเภทนี้ที่ได้จากเอนทาลปีของสารธรรมดาในสถานะมาตรฐานจึงเป็น is เอนทาลปีมาตรฐานของการก่อตัว (ΔH0).
ขณะนี้ มีสารหลายอย่างที่ไม่ได้เกิดขึ้นโดยตรงจากปฏิกิริยาเดียว เช่น น้ำ ในกรณีเช่นนี้ เอนทาลปีของการก่อตัวสามารถคำนวณได้จากความแปรผันของเอนทาลปีของปฏิกิริยา
ตัวอย่างเช่น NH4Cl เกิดขึ้นจากปฏิกิริยาต่อไปนี้:
NH3 + HCl → NH4Cl ΔH = -176 กิโลจูล/โมล
โปรดทราบว่าไม่มีสารตั้งต้นใดที่เป็นสารธรรมดา เราจึงไม่สามารถกำหนดให้เอนทาลปีเป็นศูนย์แก่พวกมันได้ เราจำเป็นต้องรู้เอนทาลปีของการก่อตัวของรีเอเจนต์แต่ละตัว เนื่องจากสิ่งเหล่านี้เกิดขึ้นจากปฏิกิริยาระหว่างสารธรรมดา:
NH3: ΔH = -46 กิโลจูล/โมล
HCl: ΔH = -92.4 kJ/โมล
เมื่อรวมเอนทาลปีทั้งสองนี้เข้าด้วยกัน เราจะได้ค่าเอนทาลปีของสารตั้งต้น และเราสามารถหาเอนทาลปีของ NH ได้4Cl:
โฮR = โฮNH3 + โฮHCl
โฮR = (-46 + (-92.4) กิโลจูล/โมล)
โฮR = -138.4 กิโลจูล/โมล
แทนที่ในสูตร:
ΔH = Hสินค้า - โฮรีเอเจนต์
-176 = HNH4Cl - ( -138,4)
โฮNH4Cl = - 176 - 138,4
โฮNH4Cl = -314.4 กิโลจูล/โมล
ในกรณีนี้ เราสรุปค่าของเอนทาลปีของการก่อตัวของสารตั้งต้นโดยตรง เนื่องจากอัตราส่วนปฏิกิริยามีเพียง 1 โมล อย่างไรก็ตาม หากในปฏิกิริยาอื่นๆ ปริมาณของโมลแตกต่างกัน จำเป็นต้องคูณเอนทาลปีของการก่อตัวของสารตั้งต้นด้วยจำนวนโมลก่อน
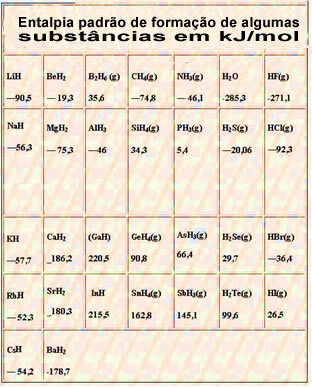
ด้านล่างเป็นตารางที่มีเอนทาลปีมาตรฐานของการก่อตัวของสารบางชนิดที่อุณหภูมิ 25 °C และ 1 atm:
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm

