ที่ แรงระหว่างโมเลกุล เป็นหัวข้อวิชาเคมีที่เข้าสอบได้ในระดับมัธยมศึกษาตอนปลายอย่างแน่นอน (แล้วก็). ดังนั้นจึงควรตรวจสอบเนื้อหาหลักของเรื่องนี้ในบทความนี้
คำนิยาม
แรงระหว่างโมเลกุล พวกมันคือแรงที่มีความเข้มต่างกัน (อ่อน ปานกลาง หรือแรง) ของแรงดึงดูดจากไฟฟ้าสถิตหรือพันธะที่สร้างขึ้นระหว่างโมเลกุลของสารที่คงไว้ซึ่งการรวมตัวระหว่างพวกมัน
ประเภทของแรงระหว่างโมเลกุล
ก) ไดโพลเหนี่ยวนำ
และ แรงระหว่างโมเลกุล ที่เกิดขึ้นระหว่างโมเลกุลของสารที่มีลักษณะไม่มีขั้ว เกิดขึ้นระหว่างโมเลกุลของสาร เช่น O2, H2, ไม่2, CO2, CH4.
การรวมตัวระหว่างโมเลกุลเหล่านี้เกิดขึ้นเมื่อไดโพลถูกสร้างขึ้นระหว่างพวกมัน สิ่งนี้เกิดขึ้นเมื่ออิเล็กตรอนจากโมเลกุลหนึ่งแทนที่อิเล็กตรอนจากอีกโมเลกุลหนึ่ง ทำให้เกิดขั้วลบและขั้วบวก ซึ่งถูกถ่ายโอนจากโมเลกุลหนึ่งไปยังอีกโมเลกุลหนึ่ง
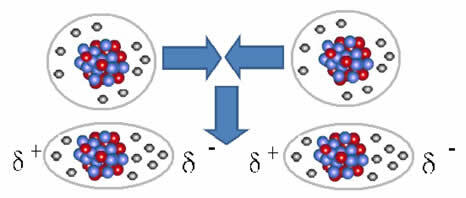
การเป็นตัวแทนของการเกิดไดโพลในโมเลกุลที่ไม่มีขั้ว
ระหว่างโมเลกุลเหล่านี้ เกิดสองขั้วขึ้น และขั้วลบของขั้วหนึ่งมีปฏิสัมพันธ์กับขั้วบวกของอีกขั้วหนึ่ง เนื่องจากขั้วเหล่านี้ถูกสร้างขึ้น จึงเป็นแรงระหว่างโมเลกุลที่มีความเข้มต่ำ
ข) ไดโพลถาวร
และ แรงระหว่างโมเลกุล ที่เกิดขึ้นระหว่างโมเลกุลของสารที่มีลักษณะขั้ว ตัวอย่างคือโมเลกุลของสาร เช่น HCN, H2O, NH3, CO, CH3ค.
การรวมตัวระหว่างโมเลกุลเหล่านี้เกิดขึ้นเมื่อขั้วลบของขั้วหนึ่งมีปฏิสัมพันธ์กับขั้วบวกของอีกขั้วหนึ่ง
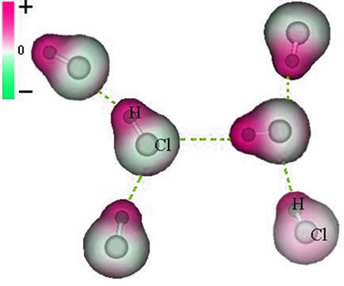
การแสดงแรงไดโพลถาวรระหว่างโมเลกุล HCl
เนื่องจากขั้วที่มีอยู่แล้ว แรงระหว่างโมเลกุลไดโพลถาวรจึงมีความเข้มมากกว่าไดโพลเหนี่ยวนำ
ค) พันธะไฮโดรเจน
ที่ แรงระหว่างโมเลกุล มันเกิดขึ้นระหว่างโมเลกุลของขั้วที่มีอะตอมไฮโดรเจนที่ถูกพันธะโดยตรงกับอะตอมออกซิเจนไนโตรเจนหรือฟลูออรีน
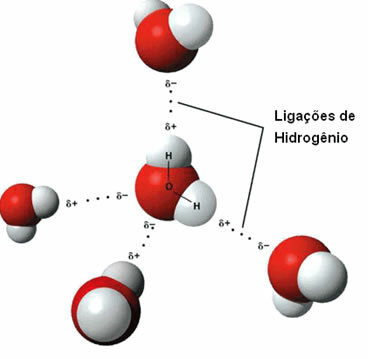
การแสดงพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ
พันธะไฮโดรเจนเกิดขึ้นเมื่อไฮโดรเจนในโมเลกุลหนึ่งมีปฏิสัมพันธ์กับออกซิเจน ไนโตรเจน หรือฟลูออรีนของโมเลกุลอื่น
d) ไดโพลไอออน
แรงระหว่างโมเลกุลนี้เกิดขึ้นระหว่างโมเลกุลที่มีขั้วซึ่งมีอิเล็กตรอนที่ไม่พันธะคู่หนึ่งกับไอออน (ไอออนบวกหรือประจุลบ) ในสารละลาย
โมเลกุลของน้ำ เช่น มีอิเลคตรอนที่ไม่มีพันธะสองคู่ในออกซิเจน หากมีไอออนในตัวกลางที่เป็นน้ำ พวกมันก็จะเข้าใกล้โมเลกุลของน้ำมากขึ้น เนื่องจากมีขั้วอยู่ในนั้น
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ความสำคัญ
ความสำคัญของการรู้จัก กองกำลังระหว่างโมเลกุลสำหรับศัตรู มันเป็นความเข้าใจที่พวกเขานำมาเกี่ยวกับสถานะทางกายภาพ จุดหลอมเหลว จุดเดือด และความสามารถในการละลายของสาร
ก) ความสัมพันธ์กับจุดหลอมเหลวและจุดเดือดของสาร
จุดหลอมเหลวระบุอุณหภูมิของการเปลี่ยนสถานะจากสถานะของแข็งเป็นของเหลว และจุดเดือดระบุอุณหภูมิของการเปลี่ยนสถานะจากของเหลวเป็นสถานะก๊าซ
ข้อความนี้เกี่ยวข้องโดยตรงกับปฏิสัมพันธ์ระหว่างโมเลกุลของสาร เนื่องจากสิ่งที่ทำให้สถานะทางกายภาพแตกต่างจากอีกสถานะหนึ่งคือระดับการรวมตัวระหว่างโมเลกุลของสาร
ดังนั้น ยิ่งแรงระหว่างโมเลกุลรุนแรงมากเท่าใด จุดหลอมเหลวและจุดเดือดก็จะยิ่งสูงขึ้น ยิ่งแรงระหว่างโมเลกุลรุนแรงน้อยเท่าใด จุดหลอมเหลวและจุดเดือดก็จะยิ่งต่ำลง ดังนั้น เราสามารถกำหนดลำดับจุดหลอมเหลวและจุดเดือดจากมากไปน้อย:
พันธะไฮโดรเจน > ไดโพลถาวร > ไดโพลเหนี่ยวนำ
ข) ความสัมพันธ์กับความสามารถในการละลาย
โดยทั่วไป เราต้องรู้ว่าสิ่งที่ชอบละลายเช่น นั่นคือ สารมีขั้วละลายสารมีขั้ว และสารไม่มีขั้วละลายสารไม่มีขั้ว
อย่างไรก็ตาม ยังคงมีความเป็นไปได้ที่จะมีปฏิสัมพันธ์ระหว่างโมเลกุลตัวถูกละลายและโมเลกุลของตัวทำละลาย สิ่งนี้จะเกิดขึ้นก็ต่อเมื่อปฏิสัมพันธ์ใหม่นี้ยิ่งใหญ่กว่าที่มีอยู่แล้วระหว่างโมเลกุลของสารเอง
ตัวอย่างการประยุกต์ใช้แรงระหว่างโมเลกุลในศัตรู
ตัวอย่างที่ 1: (Enem-2011) ผิวหนังมนุษย์เมื่อได้รับน้ำหล่อเลี้ยงอย่างดี จะได้รับความยืดหยุ่นที่ดีและมีลักษณะที่นุ่มนวลและเรียบเนียน ในทางกลับกัน เมื่อแห้งจะสูญเสียความยืดหยุ่นและมีลักษณะทึบแสงและหยาบกร้าน เพื่อป้องกันความแห้งกร้านของผิว จำเป็นต้องใช้มอยส์เจอไรเซอร์ที่ให้ความชุ่มชื้น โดยทั่วไปจะทำจากกลีเซอรีนและโพลิเอทิลีนไกลคอล

การกักเก็บน้ำบนผิวที่ส่งเสริมโดยมอยเจอร์ไรเซอร์เป็นผลมาจากการทำงานร่วมกันของกลุ่มไฮดรอกซิลของสารทำให้เปียกกับความชื้นที่มีอยู่ในสิ่งแวดล้อมผ่าน:
ก) พันธะไอออนิก
b) กองกำลังลอนดอน
c) พันธะโควาเลนต์
d) แรงไดโพล-ไดโพล
จ) พันธะไฮโดรเจน
คำตอบสำหรับคำถามนี้คือพันธะไฮโดรเจน เนื่องจากโมเลกุลของน้ำมีไฮโดรเจนจับกับอะตอมออกซิเจน สิ่งเดียวกันนี้เกิดขึ้นกับโมเลกุลของโพรพิลีนไกลคอลและโพลิเอทิลีนไกลคอล ซึ่งเป็นสภาวะที่เอื้ออำนวยต่อการเกิดแรงระหว่างโมเลกุลประเภทนี้
By Me. Diogo Lopes Dias
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "กองกำลังระหว่างโมเลกุลในศัตรู"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.