อิเล็กโทรลิซิส มันเป็นกระบวนการที่ไม่เกิดขึ้นเอง นั่นคือ กระบวนการที่ไม่เกิดขึ้นเองตามธรรมชาติ ซึ่งสารต่างๆ เกิดขึ้นจากการปล่อยประจุไฟฟ้าในสารประกอบที่ละลายหรือละลายในน้ำ ในขั้นตอนนี้ กระแสไฟฟ้าจะไปถึงภาชนะแก้ว (ถังอิเล็กโทรไลต์) ที่มีอิเล็กโทรดเฉื่อยสองขั้ว (ซึ่งไม่ได้รับผลกระทบหรือ ออกซิเดชัน นอร์ ลด) เกิดขึ้นจากกราไฟต์หรือแพลตตินั่ม อิเล็กโทรดเหล่านี้เชื่อมต่อกับแหล่งไฟฟ้า (โดยปกติa กลอง) และจุ่มลงในเกลือหรือเบสที่หลอมเหลวหรือละลายในน้ำ เช่นเดียวกับ แบตเตอรี่, อิเล็กโทรไลซิสมีแคโทด (ที่เกิดการรีดักชัน) และแอโนด (ที่เกิดออกซิเดชัน).
สรุป
อิเล็กโทรไลซิสเป็นกระบวนการที่ไม่เกิดขึ้นเอง
สารธรรมดาหรือสารผสมสามารถเกิดขึ้นได้
มันสามารถเกิดขึ้นได้กับตัวถูกละลาย (อิเล็กโทรไลต์อัคนี);
มันสามารถเกิดขึ้นได้กับตัวถูกละลายในน้ำ (อิเล็กโทรไลต์ในน้ำ);
ไอออนบวกจะลดลงที่แคโทดเสมอ
ประจุลบจะเกิดปฏิกิริยาออกซิเดชันที่ขั้วบวกเสมอ
ดูด้วย:การได้มาซึ่งอะลูมิเนียมจากอิเล็กโทรไลซิส

ประเภทของอิเล็กโทรลิซิส
เป็นอิเล็กโทรไลซิสที่เกิดขึ้นเมื่อปล่อยประจุไฟฟ้าบนสารประกอบไอออนิกหลอมเหลว สารประกอบไอออนิกเกิดจากพันธะไอออนิก เช่น a
เกลือ หรือ ฐาน อนินทรีย์ เมื่อเราพูดถึงสารประกอบที่หลอมเหลว ในทางกลับกัน เราหมายถึงสารประกอบที่เปลี่ยนจากสถานะของแข็งเป็นของเหลว- ตัวอย่างของอิเล็กโทรไลซิสอัคนี
เมื่อเราทำการหลอมรวมของโพแทสเซียมคลอไรด์ (KCl) เกลือนี้จะผ่านกระบวนการแยกตัวออกโดยปล่อยโพแทสเซียมไอออน (K+) และไอออนไอโอไดด์ (l-).

สมการการแยกตัวของโพแทสเซียมคลอไรด์
เมื่อกระแสไฟฟ้าไปถึงเซลล์อิเล็กโทรไลต์ด้วยไอออนเหล่านี้ โพแทสเซียมไอออนจะลดลง กลายเป็นโพแทสเซียมโลหะ (K) และไอออนของไอโอไดด์จะถูกออกซิไดซ์ กลายเป็นไอโอดีนที่เป็นของแข็ง (I2).
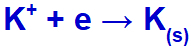
สมการการก่อตัวของโพแทสเซียมที่เป็นของแข็ง
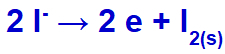
สมการการก่อตัวของไอโอดีนที่เป็นของแข็ง
เป็นอิเล็กโทรไลซิสที่เกิดขึ้นเมื่อปล่อยประจุไฟฟ้าบนสารละลายที่เป็นน้ำ (มีน้ำ) ที่เกิดจากเกลือหรือเบสอนินทรีย์
- ตัวอย่างอิเล็กโทรลิซิสในน้ำ a
เมื่อเราละลายโซเดียมคลอไรด์ในน้ำ โซเดียมคลอไรด์จะแยกตัวออก และน้ำจะถูกไอออไนซ์

น้ำแตกตัวเป็นไอออนและสมการการแยกตัวของโซเดียมคลอไรด์
เป็นโซเดียมไอออนบวก (Na+) อยู่ในตระกูล IA ไฮโดรเนียมไอออนบวก (H+) ผ่านการปล่อยและผ่านการรีดิวซ์ทำให้เกิดก๊าซไฮโดรเจน (H2).
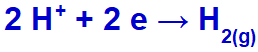
สมการการเกิดก๊าซไฮโดรเจน
เป็นคลอไรด์ (Cl-) ไม่มีออกซิเจน (ไม่มีออกซิเจน) และไม่ใช่ฟลูออไรด์ (F-) ปล่อยออกซิไดซ์และเกิดก๊าซคลอรีน (Cl2).

สมการการเกิดก๊าซคลอรีน
การปล่อยไอออนที่เลือก
ในระหว่างกระบวนการอิเล็กโทรลิซิสในตัวกลางที่เป็นน้ำ (สารละลายที่เกิดจากน้ำและตัวถูกละลาย) เราจะมีไอออนบวก 2 ตัวเสมอ: ไฮโดรเนียม จากน้ำ และอื่นๆ จาก การแยกตัวของเกลือ (ตัวอย่างของตัวถูกละลาย) เราจะมีแอนไอออนสองอันด้วย: ไฮดรอกซิลซึ่งมาจากน้ำและอีกอันหนึ่งซึ่งมาจากเกลือ

ไอออนจากไอออไนซ์ในน้ำและการแยกตัวของเกลือ
- การปลดปล่อยคัดเลือกสำหรับไพเพอร์และแอนไอออน
ถ้าไอออนบวกจากตัวถูกละลายเป็นของตระกูล IA, IIA หรือ IIIA แสดงว่าไฮโดรเนียม (H+) จะลดลง;
หากไอออนบวกที่มาจากตัวถูกละลายไม่ใช่ของครอบครัวที่กล่าวถึงข้างต้น ก็จะได้รับผลกระทบลดลง
ถ้าประจุลบจากตัวถูกละลายมีออกซิเจนอยู่ในองค์ประกอบหรือเป็นฟลูออไรด์ (F-) ไฮดรอกไซด์ (OH-) จะเกิดปฏิกิริยาออกซิเดชัน
-
หากประจุลบจากตัวถูกละลายไม่มีคุณสมบัติข้างต้น ก็จะเกิดปฏิกิริยาออกซิเดชัน
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
เป็นที่ทราบกันดีอยู่แล้วว่าน้ำมีความสามารถในการทำให้แตกตัวเป็นไอออนได้เอง ทำให้เกิดไฮโดรเนียมไอออน (H+) และไฮดรอกไซด์ (OH-) แต่การแตกตัวเป็นไอออนนี้ค่อนข้างจำกัด ข้อเท็จจริงนี้ได้รับการพิสูจน์โดยความไร้ประสิทธิภาพของน้ำบริสุทธิ์ในการนำกระแสไฟฟ้า
เช่น อิเล็กโทรลิซิส เกี่ยวข้องกับการปล่อยไฟฟ้า เพื่อทำการอิเล็กโทรไลซิสของน้ำ จำเป็นต้องละลายตัวถูกละลาย ซึ่งสนับสนุนการเลือกปล่อยไฮโดรเนียมและไฮดรอกไซด์ (ตามที่เห็นในหัวข้อเรื่องการปลดปล่อย คัดเลือก)
ถ้าเราเติมโซเดียมซัลเฟต (Na2เท่านั้น4) เช่น เราจะมีโซเดียมไอออนบวกอยู่ตรงกลาง (Na+) และไฮโดรเนียม (H+) รวมทั้งไฮดรอกไซด์แอนไอออน (OH-) และซัลเฟต (SO4-2). ดังนั้น เมื่อกระแสไฟฟ้ามาถึงถังอิเล็กโทรไลต์:
ไฮโดรเนียมจะถูกระบายออก ลดลง เนื่องจากโซเดียมอยู่ในตระกูล IA
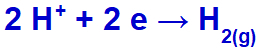
สมการการเกิดก๊าซไฮโดรเจน
ไฮดรอกไซด์จะปล่อยออกซิไดซ์เพราะซัลเฟตมีออกซิเจนอยู่ในองค์ประกอบ
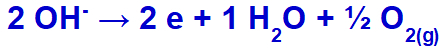
สมการการเกิดก๊าซออกซิเจน
เนื่องจากไอออนทั้งสอง (ไอออนบวกและประจุลบ) ที่มาจากน้ำถูกปล่อยออก เราจึงกล่าวได้ว่าอิเล็กโทรไลซิสของน้ำเกิดขึ้น
ดูด้วย: ลักษณะเชิงปริมาณของอิเล็กโทรไลซิส
การผลิตสารอย่างง่าย เช่น ก๊าซไฮโดรเจน (H2), ก๊าซออกซิเจน (O2) ฯลฯ ;
การผลิตสารผสม เช่น โซเดียมไฮดรอกไซด์ (NaOH), กรดซัลฟิวริก (H2เท่านั้น4) ฯลฯ ;
เคลือบชิ้นส่วนด้วยโลหะเฉพาะ เช่น ทองแดง (ทองแดง) และทอง (ชุบทอง)
ใช้เพื่อขจัดโลหะบางชนิดออกจากแร่ของคุณ
แก้ไขแบบฝึกหัดเกี่ยวกับกระแสไฟฟ้า
ตัวอย่างที่ 1 - (Vunesp) สารละลายที่เป็นน้ำของ CuC .2 จะถูกอิเล็กโทรไลซิสโดยใช้อิเล็กโทรดแพลตตินั่ม ข้อความที่ถูกต้องคือ:
ก) การลด Cu ไอออนเกิดขึ้นที่ขั้วลบ2+.
b) ออกซิเดชัน Cu ไอออนเกิดขึ้นที่ขั้วบวก2+.
c) ก๊าซคลอรีนเกิดขึ้นที่แคโทด
d) ส่วนของแพลตตินั่มแอโนดละลาย ก่อตัวเป็น Pt2+.
จ) ผลิตภัณฑ์ของอิเล็กโทรลิซิสนี้จะแตกต่างกันหากอิเล็กโทรไลซิสของ CuCl2 ร้อนแรง (ฟิวชั่น)
ก) ถูกต้อง เมื่อ CuCl2 ละลายในน้ำ เรามีไฮโดรเนียมไอออนบวก (H+) และทองแดง II (Cu+2). เนื่องจากไอออนบวกของ copper II ไม่ได้เป็นของตระกูล IA, IIA และ IIIA จึงลดลง
b) เท็จ เนื่องจากคลอไรด์ไอออน (Cl) ถูกออกซิไดซ์ที่ขั้วบวก-) ซึ่งไม่มีออกซิเจนในองค์ประกอบและไม่ใช่ฟลูออไรด์ (F-).
c) เท็จ เนื่องจากการลดลงของไอออนบวกทองแดง II เกิดขึ้นที่แคโทด ดังนั้นจึงมีการก่อตัวของโลหะทองแดง
ง) เท็จ เนื่องจากอิเล็กโทรดแพลตตินัมหรือกราไฟต์ในอิเล็กโทรลิซิสนำไฟฟ้าเท่านั้น จึงไม่มีส่วนร่วมในกระบวนการ
จ) เท็จ เนื่องจากอิเล็กโทรไลซิสของคอปเปอร์คลอไรด์ II (CuCl .)2) จะนำเสนอผลิตภัณฑ์เดียวกันทุกประการกับผลิตภัณฑ์ที่เป็นน้ำ เนื่องจากไอออนที่มีอยู่จะเป็นทองแดง II (Cu+2) และคลอไรด์ (Cl-1).
ตัวอย่างที่ 2- (UFRN) พิจารณาระบบต่อไปนี้:
ผม. โซเดียมคลอไรด์หลอมเหลว;
ครั้งที่สอง สารละลายโซเดียมคลอไรด์ในน้ำ
สาม. โซเดียมไฮดรอกไซด์ผสม;
IV. สารละลายโซเดียมไฮดรอกไซด์ในน้ำ
สารที่สามารถให้โซเดียมเมื่ออยู่ภายใต้อิเล็กโทรไลซิส ได้แก่ :
ก) เฉพาะ I และ II
b) เฉพาะ I และ III
c) เฉพาะ II และ IV
d) เฉพาะ III และ IV
จ) I, II, III และ IV
ระบบที่จ่ายโซเดียมโลหะเป็นผลิตภัณฑ์ที่แคโทดคือ I และ III
I- ไอออนบวกเพียงตัวเดียวที่มีอยู่ในตัวกลางคือโซเดียมไอออนบวก ดังนั้น มีเพียงไอออนไอออนเท่านั้นที่สามารถลดการสร้างโซเดียมโลหะได้
II- ระบบนี้ ไม่ได้ให้ โลหะโซเดียมเพราะโซเดียมคลอไรด์ถูกละลายในน้ำดังนั้นตรงกลางเรามีโซเดียมไอออนบวก (Na+) และไฮโดรเนียม (H+) - นี่คือคนที่ทนทุกข์ทรมานจากการลดลงเนื่องจากโซเดียมอยู่ในตระกูล IA
III- ไอออนบวกเพียงอย่างเดียวที่มีอยู่ในสื่อคือโซเดียมไอออน (เนื่องจากวัสดุอยู่ภายใต้การหลอมรวม) ดังนั้นจึงมีเพียงการลดลงเท่านั้นจึงกลายเป็นโซเดียมโลหะ
IV- ระบบนี้ไม่มีให้ โซเดียมที่เป็นโลหะ เนื่องจากโซเดียมไฮดรอกไซด์ละลายในน้ำ จึงมีโซเดียมไอออนอยู่ตรงกลาง (Na+) และไฮโดรเนียม (H+) - นี่คือคนที่ทนทุกข์ทรมานจากการลดลงเนื่องจากโซเดียมอยู่ในตระกูล IA
By Me. Diogo Lopes Dias