แก๊สและไอน้ำ
ความแตกต่างระหว่างก๊าซและไอน้ำนั้นมาจากอุณหภูมิวิกฤต ไอเป็นสสารในสถานะก๊าซ ซึ่งเป็นสถานะที่สามารถทำให้เป็นของเหลวได้ด้วยแรงดันที่เพิ่มขึ้น แก๊สไม่เหมือนกัน เป็นของเหลวที่ไม่สามารถทำให้เป็นของเหลวได้ด้วยแรงดันที่เพิ่มขึ้นอย่างง่าย ทำให้ก๊าซแตกต่างจากไอน้ำ
พฤติกรรมของก๊าซ
สารที่กำหนดในสถานะก๊าซคือก๊าซหากอุณหภูมิสูงกว่าอุณหภูมิวิกฤต หากอุณหภูมิเท่ากับหรือต่ำกว่าอุณหภูมิวิกฤต สารจะเป็นไอ
ก๊าซจริงที่เรามักรู้จัก เช่น ฮีเลียม ไนโตรเจน และออกซิเจน มีลักษณะโมเลกุลที่แตกต่างกันและเฉพาะเจาะจงของก๊าซแต่ละชนิด อย่างไรก็ตาม หากเราวางไว้ที่อุณหภูมิสูงและแรงดันต่ำ พวกมันจะเริ่มแสดงพฤติกรรมที่คล้ายกันมาก ในการศึกษาก๊าซ ได้นำแบบจำลองทางทฤษฎีอย่างง่ายมาใช้ ซึ่งในทางปฏิบัติไม่มีอยู่จริง โดยมีพฤติกรรมคล้ายกับก๊าซจริง การประมาณนี้จะยิ่งดีขึ้นเมื่อความดันต่ำลงและอุณหภูมิก็จะสูงขึ้น โมเดลก๊าซนี้เรียกว่า แก๊สที่สมบูรณ์แบบ.
ประมาณศตวรรษที่ 17 และ 19 นักวิทยาศาสตร์สามคน (Jacques Charles, Louis J. เกย์-ลุสแซก และ พอล อี. Clayperon) หลังจากศึกษาพฤติกรรมของก๊าซแล้ว ได้อธิบายกฎเกณฑ์ที่ควบคุมพฤติกรรมของก๊าซสมบูรณ์ ซึ่งเรียกอีกอย่างว่าก๊าซอุดมคติ กฎหมายที่กำหนดโดยพวกเขากำหนดกฎของพฤติกรรม "ภายนอก" ของก๊าซสมบูรณ์ซึ่งนำไปสู่ โดยจะนับเฉพาะปริมาณทางกายภาพที่เกี่ยวข้องกับปริมาณดังกล่าวเท่านั้น ได้แก่ ปริมาตร อุณหภูมิ และ ความดัน.
กฎทั่วไปของก๊าซสมบูรณ์
นิพจน์ที่กำหนดกฎทั่วไปสำหรับก๊าซสมบูรณ์สามารถเห็นได้ดังนี้:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
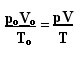
ที่ไหน pโอ, วีโอ และ Tโอ คือ ความดันตั้งต้น ปริมาตรตั้งต้น และอุณหภูมิเริ่มต้น ตามลำดับ นี่คือนิพจน์ที่ใช้เมื่อตัวแปรของก๊าซแปรผัน
กฎของบอยล์
โรเบิร์ต บอยล์ นักฟิสิกส์และนักเคมี เป็นผู้กำหนดกฎหมายที่ควบคุมการเปลี่ยนแปลงของก๊าซเมื่ออุณหภูมิคงที่ กฎของเขากล่าวว่าเมื่อก๊าซผ่านการเปลี่ยนแปลงอุณหภูมิความร้อน ความดันของก๊าซจะแปรผกผันกับปริมาตรที่ถูกครอบครอง จากกฎข้อนี้ เราจะได้สิ่งนั้นว่าอย่างไร ตู่โอ = T เราต้อง:
พีโอวีโอ = pV
กฎของชาร์ลส์
กฎของชาร์ลส์เป็นกฎที่ควบคุมการเปลี่ยนแปลงของก๊าซสมบูรณ์เป็นปริมาตรคงที่ การแปลงเหล่านี้เรียกว่าการแปลงแบบไอโซโคริกหรือไอโซเมตริก ตามกฎหมายนี้ เมื่อมวลก๊าซสมบูรณ์ผ่านการเปลี่ยนแปลงไอโซโคริก ความดันของก๊าซจะแปรผันตรงกับอุณหภูมิสัมบูรณ์ ทางคณิตศาสตร์กฎหมายนี้สามารถแสดงได้ดังนี้:

ที่ไหน pโอ และ Tโอ คือ ความดันตั้งต้นและอุณหภูมิตั้งต้นตามลำดับ
กฎของเกย์-ลูสแซก
กฎของเกย์-ลุสแซกคือกฎที่ควบคุมการเปลี่ยนแปลงของก๊าซสมบูรณ์ที่ความดันคงที่ กฎข้อนี้แม้จะมีชื่อว่า เกย์-ลุสแซก ก็ได้ถูกค้นพบโดยนักฟิสิกส์และนักเคมี เอ.ซี. ชาร์ลส์แล้ว ตามกฎหมาย เมื่อก๊าซผ่านการเปลี่ยนแปลงไอโซบาริก ปริมาตรของก๊าซจะเป็นสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์ ทางคณิตศาสตร์กฎหมายนี้สามารถแสดงได้ดังนี้:

ที่ไหน Vโอ และ Tโอ สอดคล้องกับปริมาตรเริ่มต้นและอุณหภูมิเริ่มต้นตามลำดับ
โดย Marco Aurélio da Silva
ดูเพิ่มเติม!!
การแปลงแก๊ส
รู้ว่าการเปลี่ยนแปลงของก๊าซคืออะไร.
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
ซานโตส, มาร์โก เอาเรลิโอ ดา ซิลวา "การศึกษาก๊าซ"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.