กฎของดาลตันระบุว่าแรงดันบางส่วนของก๊าซแต่ละชนิดในส่วนผสมของก๊าซนั้นเท่ากับแรงดันที่แรงดันจะกระทำต่อปริมาตรของส่วนผสมนั้นที่อุณหภูมิเท่ากัน ดังนั้น ความดันรวมของส่วนผสมของก๊าซคือผลรวมของแรงดันบางส่วนของก๊าซแต่ละชนิดที่ประกอบเป็นองค์ประกอบ
ลองพิจารณาก๊าซสองประเภทคือ A และ B แต่ละตัวมีปริมาตร V เท่ากันและมีอุณหภูมิ T เท่ากัน หากเราใช้สมการ Clapeyron กับก๊าซทั้งสอง A และ B เรามี:
พีTHE .V=nTHE .R .T และ pบี .V=nบี .R .T
ดังที่แสดงในรูปด้านบน ถ้าเราผสมก๊าซทั้งสองเข้าด้วยกัน จำนวนโมลของก๊าซในส่วนผสม (ไม่ม) มันกลายเป็น:
ไม่ม= นTHE+ นบี
ที่ไหน:
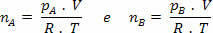
แต่ nm = (Pm.V) / R. ที; ดังนั้นเราจึงมี:
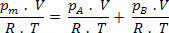
ทำให้ง่ายขึ้นในนิพจน์ข้างต้น เรามี:
พีม=pTHE+ พีบี (กฎของดาลตัน)
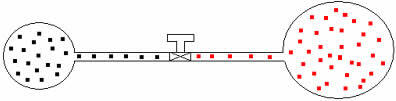
เราสามารถใช้เหตุผลเดียวกันกับก๊าซที่มีปริมาตรและอุณหภูมิต่างกันได้ ลองดูรูปด้านล่างซึ่งบอลลูนสองลูกเชื่อมต่อกันด้วยหลอดที่มีปริมาตรเล็กน้อยมีการสัมผัส ลูกโป่งเหล่านี้มีสองก๊าซ A และ B โดยมีอุณหภูมิและปริมาตรต่างกัน จากรูปจะเห็นว่า faucet ถูกปิด ดังนั้น:
พีTHE .V=nTHE .R .T และ pบี .V=nบี .R .T
ต่อมาถ้าเราเปิด Faucet เราจะเห็นว่ามีแก๊สผสมกัน ดังแสดงในภาพประกอบด้านล่าง:
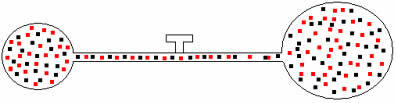
สำหรับส่วนผสมนี้ เรามีความสัมพันธ์ดังต่อไปนี้:
วีม=VTHE+ วีบี
พีTHE .V=nTHE .R .T
พีบี .V=nบี .R .T
ดังนั้น เรามีว่าความสัมพันธ์สุดท้ายของสารผสมนี้สามารถขยายเป็นส่วนผสมของ ไม่ ก๊าซ ดังนั้น:
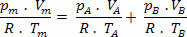
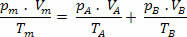
โดย Domitiano Marques
จบฟิสิกส์
ทีมโรงเรียนบราซิล

