สารประกอบอินทรีย์สามารถแสดงได้หลายวิธี เช่น สูตรโครงสร้างแบบเรียบ สูตรโครงสร้างแบบง่ายหรือแบบย่อ หรือสูตรแบบเส้นประ อย่างไรก็ตาม การแสดงแทนที่ง่ายที่สุดคือการใช้สูตรโมเลกุล

เรามาดูวิธีการกำหนดสูตรโมเลกุลของสารประกอบอินทรีย์ตามสูตรอื่นๆ ที่กล่าวถึงข้างต้น
1. ผ่านสูตรโครงสร้างแบบเรียบ:สูตรนี้แสดงการจัดเรียงหรือการจัดเรียงของอะตอมภายในโมเลกุล ตัวอย่างเช่น ด้านล่างเป็นสูตรโครงสร้างเรียบของหนึ่งในไฮโดรคาร์บอนที่มีอยู่ในน้ำมันเบนซิน

โปรดทราบว่าในสูตรนี้ อะตอมทั้งหมดและพันธะที่มีอยู่ทั้งหมดจะแสดงขึ้น ตอนนี้ ในการหาสูตรโมเลกุลของสารประกอบนี้ เพียงแค่นับจำนวนอะตอมของธาตุแต่ละชนิดแล้ววางดัชนีไว้ที่ด้านล่างขวาของธาตุที่เป็นปัญหา
สิ่งสำคัญที่ต้องเน้นคือ เราเริ่มต้นสูตรโมเลกุลของสารประกอบอินทรีย์จากธาตุคาร์บอนเสมอเนื่องจากเป็นส่วนประกอบหลักของสารเหล่านี้ ดูตัวอย่าง:
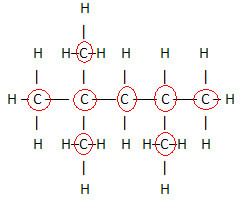
เนื่องจากมีคาร์บอน 8 ตัว เราจึงเริ่มเขียนสูตรโมเลกุลดังนี้: ค8
เพื่อให้สูตรนี้สมบูรณ์ เรานับปริมาณไฮโดรเจน:
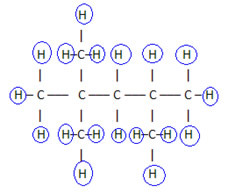
ดังนั้นคุณ สูตรโมเลกุล é ค8โฮ18.
2. ผ่านสูตรโครงสร้างแบบย่อหรือแบบย่อ: ในสูตรประเภทนี้ ปริมาณไฮโดรเจนเป็นตัวย่อ ตัวอย่างเช่น ดูสูตรเดียวกันสำหรับโมเลกุลที่พบในน้ำมันเบนซิน ซึ่งขณะนี้อยู่ในรูปแบบย่อ:
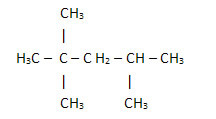
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
วิธีนี้จะง่ายยิ่งขึ้นในการนับปริมาณไฮโดรเจน เพียงเติมดัชนี (3 +3+ 3 +2 +1 +3 +3 = 18)
แต่ตอนนี้เรามาดูสูตรโครงสร้างควบแน่นของกรดไลโนเลอิกซึ่งมีอยู่ในผักต่างๆ เช่น ฝ้าย ถั่วเหลือง ทานตะวัน เป็นต้น และที่ใช้ในสีและเคลือบเงา:
โฮ3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
การนับปริมาณคาร์บอน ไฮโดรเจน และออกซิเจน มีดังต่อไปนี้ สูตรโมเลกุล ของกรดไลโนเลอิก: ค18โฮ32อู๋2.
3. ผ่านสูตรจังหวะ: สูตรนี้ช่วยลดความยุ่งยากในการแสดงสารประกอบอินทรีย์ โดยละเว้นหมู่ C, CH, CH2 และ CH3.
ตัวอย่างคือโมเลกุลไลโนเลอิก ดูว่ามันมีลักษณะอย่างไร:

เรามานับปริมาณคาร์บอนกันก่อน โดยจำไว้ว่า ในสูตรนี้ พันธะระหว่างคาร์บอนแต่ละตัวจะถูกแทนด้วยเส้นประ ดังนั้นเคล็ดลับเช่นเดียวกับจุดเปลี่ยนสองจุดจึงสอดคล้องกับอะตอมของคาร์บอน
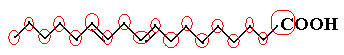
ดังนั้นเราจึงมี: ค18
ในการนับปริมาณไฮโดรเจน เราต้องจำไว้ว่าพันธะระหว่างคาร์บอนและไฮโดรเจนนั้นบอกเป็นนัย เนื่องจากเป็นที่ทราบกันว่าคาร์บอนสร้างพันธะสี่พันธะ ดังนั้นจำนวนของพันธะที่ขาดหายไปคือปริมาณของไฮโดรเจนที่ถูกผูกมัดกับธาตุนั้น
ดูคำอธิบายด้านล่าง:
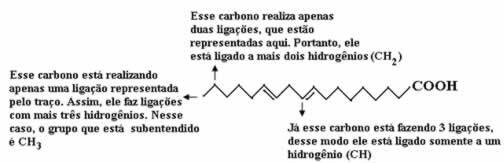
ดังนั้นปริมาณไฮโดรเจนจะเท่ากับ 32

ปริมาณออกซิเจนนั้นนับได้ค่อนข้างง่าย เนื่องจากมีเพียงสองเท่านั้น ตั้งแต่ สูตรโมเลกุล é: ค18โฮ32อู๋2.
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "สูตรโมเลกุลของสารประกอบอินทรีย์"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.
สูตรเชิงพื้นที่ของคาร์บอน สูตรอิเล็กทรอนิกส์ของลูอิส โครงสร้างระนาบ คู่อิเล็กทรอนิกส์ พันธะ โควาเลนต์, ชั้นเวเลนซ์, วิวัฒนาการของแบบจำลองอะตอม, สูตรโมเลกุล, สูตรโครงสร้าง, สูตร สามมิติ
สูตรเคมี สูตรโครงสร้างแบน สูตรโครงสร้างคูเปอร์ พันธะสาม แก๊ส ไนโตรเจน, สูตรอิเล็กทรอนิกส์, สูตรลิวอิส, สูตรโมเลกุล, พันธะเดี่ยว, พันธะคู่, แก๊ส คาร์บอนิก