ลองนึกภาพว่าคุณเติมเกลือแกง 10 กรัม (โซเดียมคลอไรด์ - โซเดียมคลอไรด์) ลงในแก้วที่มีน้ำ 100 กรัมที่อุณหภูมิ 20ºC หลังจากผสมแล้ว คุณจะเห็นว่าเกลือละลายหมดแล้ว คุณจึงตัดสินใจใส่เกลือเพิ่มเข้าไปอีก เมื่อถึงจุดหนึ่ง คุณจะไม่สามารถละลายเกลือในน้ำปริมาณนั้นได้อีกต่อไป และเกลือที่เติมลงไปจะจมลงสู่ก้นแก้ว ไม่ว่าคุณจะพยายามผสมมันมากแค่ไหนก็ตาม
เมื่อสิ่งนั้นเกิดขึ้น เราว่าวิธีแก้ปัญหาคือ อิ่มตัว และที่ ค่าสัมประสิทธิ์การละลาย. ดังนั้นเราจึงสามารถกำหนดสัมประสิทธิ์การละลายได้ดังนี้:
“ค่าสัมประสิทธิ์การละลายคือปริมาณสูงสุดของตัวถูกละลายที่ละลายได้ในปริมาณตัวทำละลายที่กำหนด ที่อุณหภูมิที่กำหนด”
ค่าสัมประสิทธิ์การละลายของเกลือในน้ำ เช่น เท่ากับ NaCl 36 กรัม / น้ำ 100 กรัม ที่อุณหภูมิ 20ºC เป็นไปไม่ได้ที่จะละลายเกลือเกินหนึ่งกรัมในน้ำปริมาณนี้และที่อุณหภูมินี้เช่น ค่าสัมประสิทธิ์การละลายจะจำเพาะสำหรับสารแต่ละชนิด ถ้าเราเปลี่ยนตัวถูกละลาย เช่น แทนที่เกลือแกงด้วย NH4Cl นี่มีค่าสัมประสิทธิ์การละลายเท่ากับ 37.2 ก. ในน้ำ 100 ก. ที่อุณหภูมิ 20°C
นอกจากนี้ สารชนิดเดียวกันมีความสามารถในการละลายต่างกันในตัวทำละลายที่ต่างกัน.
แม้ว่าเกลือจะละลายได้ในน้ำ แต่ก็แทบไม่ละลายในอะซิโตนหรือเอทิลอะซิเตต (ตัวทำละลายที่ใช้ขจัดสารเคลือบ)อีกประเด็นหนึ่งคือเมื่อใดก็ตามที่กล่าวถึงค่าสัมประสิทธิ์การละลายของตัวถูกละลายในปริมาณตัวทำละลายที่กำหนด จำเป็นต้องระบุอุณหภูมิด้วยเนื่องจากเป็นปัจจัยขัดขวาง ตัวอย่างเช่น หากเราใช้น้ำ 100 กรัมที่อุณหภูมิ 20°C และเติมเกลือ 40 กรัมลงไป 36 กรัมจะละลายและ 4 กรัมจะทำให้เกิดตะกอน แต่ถ้าเราใช้สารละลายนี้เพื่อให้ความร้อน เราจะเห็นว่า 4 กรัมจะละลายเมื่ออุณหภูมิสูงขึ้น
นี่แสดงให้เราเห็นว่าตัวถูกละลายตัวเดียวกันที่ละลายในปริมาณตัวทำละลายเท่ากันมีค่าสัมประสิทธิ์การละลายต่างกันเมื่ออุณหภูมิเพิ่มขึ้น
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ดูตัวอย่างด้านล่าง:
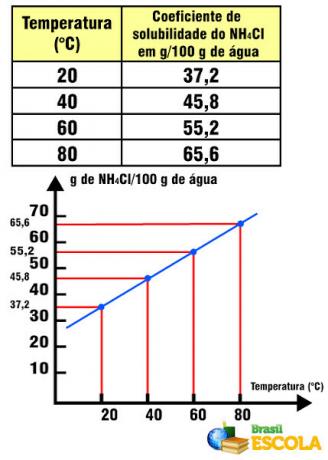
ค่าสัมประสิทธิ์การละลายของ NH4Cl สัมพันธ์กับอุณหภูมิ
โปรดทราบว่าในกรณีนี้สัมประสิทธิ์การละลายของ NH4Cl เพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น สิ่งนี้เกิดขึ้นกับเกลือส่วนใหญ่ในน้ำ อย่างไรก็ตาม มีบางสถานการณ์ที่ค่าสัมประสิทธิ์การละลายลดลงตามอุณหภูมิที่เพิ่มขึ้น เช่นในกรณีของ Ce2(เท่านั้น4)3. นอกจากนี้ยังมีบางกรณีที่ค่าสัมประสิทธิ์การละลายไม่มีความแปรปรวนที่ทำเครื่องหมายไว้เช่นที่เกิดขึ้นกับเกลือแกง ดูสิ่งนี้ในข้อความ กราฟของเส้นโค้งการละลาย.
อาจเป็นไปได้ว่าในบางสถานการณ์เราสามารถละลายปริมาณตัวถูกละลายในตัวทำละลายที่มากกว่าค่าสัมประสิทธิ์การละลายของมันได้ ดังนั้นจึงได้สิ่งที่เรียกว่า สารละลายอิ่มตัวยิ่งยวด ตัวอย่างเช่น ลองจินตนาการว่าสารละลายที่เกิดจากน้ำ 100 กรัม ที่อุณหภูมิ 20°C และเกลือแกง 40 กรัม (ด้วย 36 กรัม ละลายและตกตะกอน 4 กรัม) ให้ความร้อนจนได้อุณหภูมิที่ตัวถูกละลายทั้งหมด ละลายตัวเอง จากนั้นจึงปล่อยให้สารละลายนี้พักเพื่อให้เย็นตัวลงจนกว่าจะถึงอุณหภูมิห้อง ซึ่งใกล้เคียงกับ 20ºC
หากไม่มีสิ่งรบกวนในสารละลาย ตัวถูกละลายที่เกินมาจะยังคงละลายอยู่ ดังนั้นจึงเป็นสารละลายอิ่มตัวยิ่งยวด อย่างไรก็ตาม สารละลายประเภทนี้ไม่เสถียรมาก และการเคลื่อนไหวอย่างกะทันหันอาจทำให้ปริมาณที่สูงกว่าค่าสัมประสิทธิ์การละลายของอุณหภูมินั้นตกผลึกได้ ดังนั้น วิธีแก้คือ supersaturated จะกลายเป็น อิ่มตัวด้วยพื้นหลังร่างกาย.
กรณีสุดท้ายคือ สารละลายไม่อิ่มตัวซึ่งก็คือเมื่อปริมาณตัวถูกละลายที่ละลายน้อยกว่าค่าสัมประสิทธิ์การละลาย ตัวอย่างคือการละลายของ NaCl 10 กรัมในน้ำ 100 กรัม ที่อุณหภูมิ 20°C
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ค่าสัมประสิทธิ์การละลาย"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.