ลักษณะเด่นที่สำคัญของปฏิกิริยารีดอกซ์คือ สารเคมีชนิดหนึ่งจะสูญเสียอิเล็กตรอนไปพร้อมกัน (โดยการออกซิไดซ์) และอีกชนิดหนึ่งได้รับอิเล็กตรอน (โดยการลด)
อย่างไรก็ตาม ในปฏิกิริยาบางอย่าง สังเกตได้ว่าไม่เพียงแต่การเกิดออกซิเดชันและ/หรือการลดลงเท่านั้น ด้านล่างนี้เป็นตัวอย่าง:
SnS + HCl + HNO3 → SnCl4 + S + ไม่ + H2อู๋
การคำนวณเลขออกซิเดชัน (Nox) ของอะตอมทั้งหมดในปฏิกิริยานี้ ตามที่ได้สอนไว้ในข้อความ “การหาค่าเลขออกซิเดชัน (Nox)” เรามี:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + ไม่ + H2อู๋
มาดูกันดีกว่าว่าอันไหนสารได้รับผลกระทบจากการเปลี่ยนแปลงใน Nox และด้วยเหตุนี้ซึ่งออกซิไดซ์และลดลง:
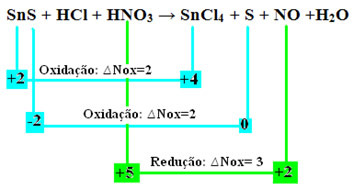
โปรดทราบว่าเกิดออกซิเดชันสองครั้ง แล้วในกรณีนั้น จะปรับสมดุลสมการเคมีได้อย่างไร?
สิ่งสำคัญอย่างหนึ่งที่ต้องจำไว้ใช้กับปฏิกิริยารีดอกซ์ทั้งหมดคือ จำนวนอิเล็กตรอนที่แจกต้องเท่ากับจำนวนอิเล็กตรอนที่ได้รับเสมอ
ดังนั้นเพื่อสร้างสมดุลของปฏิกิริยาประเภทนี้ ให้ปฏิบัติตามกฎเดียวกันกับที่กำหนดไว้ในข้อความ "สมดุลรีดอกซ์” อย่างไรก็ตาม ด้วยการเปลี่ยนแปลงเพียงครั้งเดียว: การหาค่าความแปรผันของ Nox (∆Nox) ของสปีชีส์ที่สร้างสองออกซิเดชัน (SnS) จะเป็นผลรวมของทั้งสอง ∆Nox ซึ่งจะให้มูลค่ารวมของอิเล็กตรอนที่สูญเสียไป:
- SnS: ∆จำนวน Nox ทั้งหมด = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆รวม NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
ดังนั้น เราสามารถดำเนินการตามขั้นตอนต่อไปนี้เพื่อสร้างสมดุล:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
- SnS: ∆รวม NOx = 4 → 4 จะเป็นค่าสัมประสิทธิ์ HNO3;
- HNO3: ∆Nox = 3 → 3 จะเป็นสัมประสิทธิ์ของ SnS
3 SnS + HCl + 4 HNO3 → SnCl4 + S + ไม่ + H2อู๋
ดำเนินการสร้างสมดุลโดยวิธีทดลอง:
- เนื่องจากคุณมี 3 Sn และ 3 S ในสมาชิกที่ 1 สิ่งเหล่านี้จะเป็นค่าสัมประสิทธิ์ของคุณในสมาชิกตัวที่ 2 ด้วย:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+NO+H2อู๋
- ด้วยเหตุนี้สมาชิกคนที่ 2 จึงเหลือ 12 Cl (3. 4 = 12) ดังนั้น 12 จะเป็นสัมประสิทธิ์ของสารที่พบ Cl ในสมาชิกที่ 1 ซึ่งก็คือ HCl:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + ไม่ +H2อู๋
- ตอนนี้เรามี 16 H ในสมาชิกที่ 1 (12 + 4 = 16) ดังนั้นสัมประสิทธิ์ของH2O จะเท่ากับ 8 เพราะ 8 คูณด้วยดัชนีไฮโดรเจน ซึ่งเท่ากับ 2 ให้ 16:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 วินาที + ไม่ +8ชม2อู๋
- นอกจากนี้ ในสมาชิกที่ 1 ยังมี 4 N ดังนั้น 4 จะเป็นสัมประสิทธิ์ของ N ในสมาชิกตัวที่ 2 ด้วย:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 วินาที + 4 ไม่ +8 ชั่วโมง2อู๋
โปรดทราบว่าปริมาณออกซิเจนในแขนขาที่ 1 (3. 4 = 12) เท่ากับจำนวนรวมขององค์ประกอบนั้นในกิ่งที่ 2 (4 + 8 = 12) ปฏิกิริยาจึงสมดุล
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "ปฏิกิริยาที่มีการเกิดออกซิเดชันและ/หรือการลดลงมากกว่าหนึ่งรายการ"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. เข้าถึงเมื่อ 27 กรกฎาคม 2021.