ТХЕ електронегативност то је тенденција атома да привлачи електроне ка себи када је повезан са другим хемијским елементом. кроз ковалентну везу, односно у којој се деле електрони, узимајући у обзир овај молекул изолован.
Размотримо два примера за боље разумевање представљеног концепта:
1. пример: Молекул водоничног гаса: Х.2 → Х - Х
Када се два атома водоника споје, истовремено се јављају силе привлачења између једра сваког од њих. један од ових атома електроном другог атома и силе одбијања између електрона и језгара два атома. Када ове силе достигну равнотежу, два електрона се налазе у пределу електросфера који је негде између њих. атоми молекула, у којима оба делују са два електрона, постајући стабилни, односно два атома деле пар електрони.
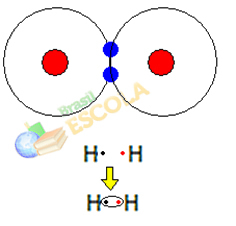
Ово је ковалентна веза која формира молекул. Али пошто су два атома овог молекула потпуно иста, начин на који привлаче електроне један према другом је такође исти. Тако ми то кажемо нема разлике у електронегативности или да она то је аполарно.
Други пример: Молекул водоник-хлорида: ХЦℓ
У овом случају, дељење електронског пара врши се између различитих елемената, јер, с тим у вези, атом хлора привлачи електроне већим интензитетом од водоника. Стога кажемо да је хлор електронегативнији од водоника.
Као што је приказано на доњој слици, због разлике у електронегативности, а електрични дипол (μ), то су два електрична монопола, са електронима који теже хлору. Тако ће веза Х ─ Цℓ имати делимично негативно наелектрисање на хлору (δ-) и делимичног позитивног наелектрисања на водонику (δ+). Дакле, ово је молекул са разликом електронегативности и поларни:
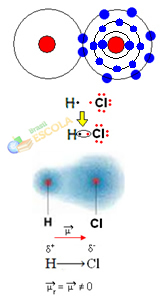
То нам показује да је електронегативност релативна, а не апсолутна величина, јер се одређује узимајући у обзир поређења сила које атоми делују у ковалентној вези.
Постоји неколико начина за израчунавање електронегативности, али најчешћи је скала електронегативности коју је предложио Паулинг. Рецимо да имамо генерички молекул А ─ Б. Паулинг је предложио да се енергија везивања овог молекула, коју симболизује Д, даје збројем аритметичке средине енергија везивања (Д) молекула гаса ова два атома, односно А-А и Б-Б, са квадратом разлике у електронегативности сваког атома тог молекула (ИксТХЕ и кБ.):
Д.(А-Б) = [Д.(А-А) + Д.(Б-Б)] + к (кТХЕ - ИксБ.)2
Константа к у горњој формули једнака је 96,5 кЈ. мол-1. Паулинг је доделио произвољну вредност електронегативности водоника, која је била 2,1, и, на тај начин је било могуће открити вредност електронегативности осталих елемената у односу на он.
На основу ове методе дате су Паулингове вредности електронегативности за елементе Периодног система, са изузетком племенитих гасова.

Имајте на уму да су ове вредности периодично својство, јер се периодично разликују на основу атомских бројева елемената. Погледајте, на пример, да су најелектронегативнији елементи они у горњем десном углу стола, односно флуор (4.0) и кисеоник (3.5), а најмање електронегативни су они у доњем левом углу, а то су францијум (0.8) и цезијум (0,8).
На основу овога, чак је створен низ електронегативности најелектронегативнијих елемената који се највише раде:
Ф> О> Н> Цℓ> Бр> И> С> Ц> П> Х
Погледајте вредности електронегативности:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Постоји својеврсни „трик“ за украшавање овог реда електронегативности, који је дат доњом реченицом, у којој почетни знак сваке речи одговара симболу дотичних елемената:
“ФЗдраво О.немам Н.О. Клубе, брдобио сам ЈасЈао Цумирање П.за Х.болница"
Тако да то можемо рећи електронегативност је периодично својство које се повећава с лева на десно и одоздо према горе на Периодном систему.

То је због величине атомског радијуса. Што је већи радијус атома, то су заједнички електрони удаљенији од његовог језгра и, према томе, слабија привлачност између њих. Тачно је и супротно, што је мањи радијус атома, то ће електрони бити ближе језгру и већа привлачност између њих. Дакле, можемо закључити следеће:
Електронегативност се повећава са смањењем атомског радијуса.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm

