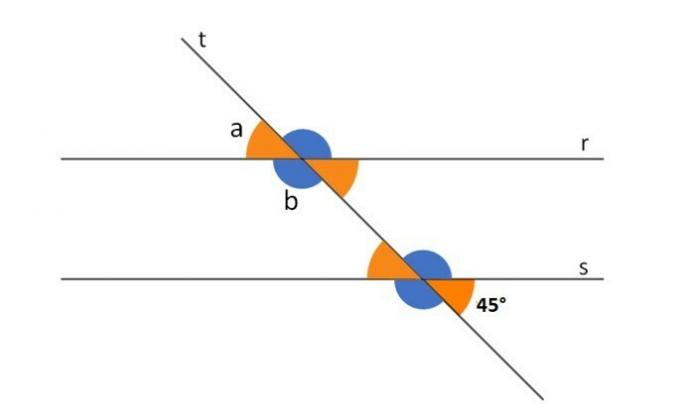
Хемијска равнотежа је један од предмета који највише падну на Енем-у и пријемним испитима.
Аспекти реверзибилних реакција обрађују се у питањима, а кандидати се вреднују прорачунима и концептима који укључују ову тему.
Имајући то на уму, направили смо ову листу питања са различитим приступима хемијској равнотежи.
Искористите коментаре резолуције да бисте се припремили за испите и погледајте детаљна упутства о томе како да решите питања.
Општи концепти хемијске равнотеже
1. (Уема) У једначини , након постизања хемијске равнотеже, можемо закључити константу равнотеже
, о чему је тачно тврдити да:
а) што је већа вредност Кц, то је нижи принос директне реакције.
б) К.ц без обзира на температуру.
в) ако су брзине напред и инверзне реакције једнаке, онда је Кц = 0.
д) К.ц то зависи од почетних моларности реактаната.
д) што је већа вредност Кц, већа је концентрација производа.
Тачан одговор: е) што је већа вредност Кц, већа је концентрација производа.
Директна реакција је представљена бројем 1, где:
Обрнуту реакцију представља
Вредност К.ц израчунава се односом између концентрација производа и реагенса.
Бројилац (који садржи производе) је директно пропорционалан константи равнотеже. Због тога је већа вредност К.ц, већи је принос директне реакције, јер се ствара више производа и, сходно томе, већа је концентрација производа.
Вредност К.ц варира у зависности од температуре, јер када променимо његову вредност, ендотермна (апсорпција топлоте) или егзотермна (ослобађање топлоте) реакција може бити и тиме се може потрошити или створити више реагенса или производа, мењајући на тај начин константу равнотеже која зависи од концентрације реагенси.
Кц зависи од моларних количина компонената када се успостави равнотежа и када су брзине директне и реверзне реакције једнаке.
2. (УФРН) Хемијска равнотежа се одликује динамичношћу на микроскопском нивоу. За добијање квантитативних информација о степену хемијске равнотеже користи се константна равнотежна количина. Узмите у обзир следећу траку:

Примењена на хемијску равнотежу, идеја лика о равнотежи:
а) Тачно је, јер је у хемијској равнотежи половина количине увек производи, а друга половина реактанти.
б) Није тачно, јер у хемијској равнотежи концентрације производа и реактаната могу бити различите, али су константне.
в) Тачно је, јер су у хемијској равнотежи концентрације реактаната и производа увек исте, све док равнотежу не нарушава спољни ефекат.
д) Није тачно, јер су у хемијској равнотежи концентрације производа увек веће од концентрација реактаната, све док на равнотежу не утиче спољни фактор.
е) Тачно је, јер у хемијској равнотежи концентрације реактаната и производа нису увек исте.
Тачан одговор: б) Није тачан, јер се у хемијској равнотежи концентрације производа и реактаната могу разликовати, али су константне.
У равнотежи, количине производа и реагенса могу се израчунати на основу константе од равнотежа, и не мора нужно бити половина количине производа, а друга половина реагенси.
Равнотежне концентрације нису увек исте, могу бити различите, али константне ако у равнотежи не дође до поремећаја.
Равнотежне концентрације треба да зависе од тога којој реакцији се даје предност, било директној или инверзној. То можемо знати по вредности К.ц: ако је К.ц 1, фаворизује се директна реакција. већ ако је К.ц
1 фаворизује се обрнута реакција.
Графикони хемијског биланса
3. (УФПЕ) Почетком 20. века очекивања Првог светског рата створила су велику потребу за једињењима азота. Хабер је пионир у производњи амонијака од азота у ваздуху. Ако се амонијак стави у затворену посуду, он се разлаже према следећој неуравнотеженој хемијској једначини: НХ3(г) → Н2 (г) + Х2 (г). Варијације концентрација током времена приказане су на следећој слици:

Из анализе горње слике можемо констатовати да криве А, Б и Ц представљају временску варијацију концентрација следећих компонената реакције:
Ах2, не2 и НХ3
б) НХ3, Х2 и без2
ц) НХ3, не2 и Х.2
д) Не2, Х2 и НХ3
е) Х.2, НХ3 и без2
Тачан одговор: г) Н.2, Х2 и НХ3.
1. корак: уравнотежити хемијску једначину.
2 НХ3(г) → Н2 (г) + 3 Х.2 (г)
Уравнотеженом реакцијом схватили смо да су потребна два мола амонијака да се разграде у азот и водоник. Такође, количина водоника произведена у реакцији је три пута већа од количине амонијака.
2. корак: тумачење података графикона.
Ако се амонијак разграђује, тада је на графикону његова концентрација максимална и опада, као што се види на кривој Ц.
Производи, како настају, на почетку реакције концентрације су нула и повећавају се како реактант постаје производ.
Пошто је количина произведеног водоника три пута већа од азота, онда је крива за овај гас највећа, као што је примећено у Б.
Други производ који се формира је азот, као што се види на кривој А.
4. (Цесгранрио) Систем представљен једначином био у равнотежи. Стање равнотеже нагло је промењено додавањем супстанце Г. Систем реагује како би успоставио равнотежу. Која од следећих табела најбоље представља промене које су се догодиле током описаног процеса?

Тачан одговор: г).

Како је систем на почетку био у равнотежи, количине супстанци Г и Х остале су константне.
До поремећаја је дошло када се концентрација Г повећавала и систем је реаговао трансформишући ово реактант у више производа Х померајући равнотежу удесно, то јест фаворизујући реакцију директан.
Примећујемо да се крива реагенса Г смањује како се троши, а крива производа Х повећава како се формира.
Када се успостави нова равнотежа, количине поново постају константне.
Константа равнотеже: однос између концентрације и притиска
5. (УФРН) Знајући да је К.П. = Кц (РТ)н, можемо рећи да је К.П. = Кц, за:
челика2(г) + Х2 (г) ↔ ЦО(г) + Х2О.(г)
б) Х.2 (г) + ½ тхе2 (г) ↔ Х2О.(1)
ц) Не2 (г) + 3 Х.2 (г) НХ 2 НХ3(г)
д) НЕ(г) + ½ О2(г) ↔ НЕ2(г)
е) 4 ФеС(с) + 7 О.2 (г) Фе 2 Фе2О.3 (с) + 4 СО2(г)
Тачан одговор: а) ЦО2(г) + Х2 (г) ↔ ЦО(г) + Х2О.(г)
КП. бити једнак К.ц варијација броја мадежа мора бити једнака нули, јер сваки број подигнут на нулу резултира 1:
К.П. = Кц (РТ)0
К.П. = Кц к 1
К.П. = Кц
Промена броја мадежа израчунава се према:
=н = Број молова производа - Број молова реагенаса
У овом прорачуну учествују само коефицијенти супстанци у гасовитом стању.
Примењујући сваку алтернативну једначину, имамо:
| челика2(г) + Х2 (г) ↔ ЦО(г) + Х2О.(г) | ∆н = [(1 + 1) - (1 + 1)] = 2 - 2 = 0 |
| б) Х.2 (г) + ½ тхе2 (г) ↔ Х2О.(1) | ∆н = [0 - (1 + 1/2)] = 0 - 3/2 = - 3/2 |
| ц) Не2 (г) + 3 Х.2 (г) НХ 2 НХ3 (г) | ∆н = [2 - (1 + 3)] = 2 - 4 = - 2 |
| д) НЕ(г) + ½ тхе2 (г) ↔ НЕ2 (г) | ∆н = [1 - (1 + 1/2)] = 1 - 3/2 = - 1/2 |
| е) 4 ФеС(с) + 7 О.2 (г) Фе 2 Фе2О.3 (с) + 4 СО2 (г) | ∆н = [(0 + 4) - (0 + 7)] = 4 - 7 = - 3 |
Са овим резултатима можемо уочити да је алтернатива чија вредност одговара траженом резултату она у првој једначини.
6. (УЕЛ-прилагођено) За реакцију представљену константе равнотеже К.ц и К.П. изражени су једначинама: (дато: п = парцијални притисак)
Тачна алтернатива:
Константа равнотеже израчунава се према:
Чврста једињења због својих константних концентрација не учествују у израчунавању Кц, дакле, константа равнотеже за дату једначину је:
За константу равнотеже, у смислу притиска, у израчунавању учествују само гасови, па:
Израчунавање константе равнотеже
7. (Енем / 2015) Неколико киселина се користи у индустријама које отпадне воде одлажу у водена тела, попут река и језера, што може утицати на равнотежу животне средине. Да би се неутралисала киселост, у отпадне воде се може додати калцијум-карбонатна сол, у одговарајућим количинама, јер производи бикарбонат, који неутралише воду. Представљене су једначине укључене у процес:

На основу вредности константи равнотеже реакција ИИ, ИИИ и ИВ на 25 ° Ц, колика је нумеричка вредност константе равнотеже реакције И?
а) 4,5 к 10-26
б) 5,0 к 10-5
в) 0,8 к 10-9
г) 0,2 к 105
д) 2,2 к 1026
Тачан одговор: б) 5,0 к 10-5
1. корак: користите Хесс-ов закон да извршите потребна прилагођавања.
С обзиром на хемијску једначину:
Константа се израчунава према:
Али ако обрнемо једначину, добићемо као резултат:
А константа постаје обрнуто:
Да бисмо дошли до једначине 1, дате у питању, морамо обрнути једначину ИИ, као у претходном примеру.
2. корак: Манипулишите једначинама ИИ, ИИИ и ИВ да бисте добили резултат једначине И.
3. корак: израчунати константу равнотеже једначине И.
Израчунавање К.Ја врши се множењем константних вредности.
Како у прорачуну имамо једнаке потенцијале база, понављамо базу и додајемо експоненте.
Пошто сада имамо дељење са једнаким степенима основа, понављамо базу и одузимамо експоненте.
8. (УнБ) Фосфор пентахлорид је веома важан реагенс у органској хемији. Припрема се у гасној фази реакцијом:
Боца капацитета 3,00 Л садржи у равнотежи, на 200 ° Ц, 0,120 мол ПЦл5(г)0,600 мол ПЦИ3(г) и 0,0120 мол ЦЛ2(г). Колика је вредност константе равнотеже на овој температури?
Тачан одговор: 50 (мол / Л)-1
1. корак: Саставите израз константе равнотеже за реакцију.
2. корак: израчунати концентрације у молима / Л сваке компоненте у равнотежи.
Формула моларне концентрације:
| ПЦл3 | Кл2 | ПЦл5 |
3. корак: замените концентрације у константном изразу и израчунајте вредност К.ц.
Примене равнотежне равнотеже
9. (Енем / 2016) Након њиховог потпуног хабања, гуме се могу спалити да би се произвела енергија. Међу гасовима који настају у потпуном сагоревању вулканизоване гуме, неки су загађивачи и изазивају киселе кише. Да би се спречило њихово бекство у атмосферу, ови гасови се могу мехурити у водени раствор који садржи одговарајућу супстанцу. Узмите у обзир податке о супстанци наведеним у табели.

Међу супстанцама наведеним у табели, она која је у стању да најефикасније уклања загађујуће гасове је (а)
а) фенол.
б) пиридин.
ц) Метиламин.
г) калијум хидроген фосфат.
е) калијум хидроген сулфат.
Тачан одговор: г) калијум хидроген фосфат.
ЦО2, оксиди сумпора (СО2 и тако3) и азотних оксида (НО и НО2) су главни загађујући гасови.
Када реагују са водом присутном у атмосфери, постоји стварање киселине који узрокују пораст киселости кише, због чега се и назива кисела киша.
Константе равнотеже дате у табели израчунавају се односом концентрација производа и реагенса на следећи начин:
Имајте на уму да је константа равнотеже пропорционална концентрацији производа: што је већа количина производа, већа је и вредност Кц.
Обратите пажњу на вредности првог и последњег композита у табели за К.ц:
| пиридин | ||
| Калијум хидроген сулфат |
Упоређујући два броја, видимо да је мања негативна снага већа вредност константе.
Да би се загађивачи ефикасније уклонили, ОХ- да реагује са јонима Х.+ присутан у киселинама кроз а реакција неутрализације.
Међу представљеним супстанцама, оне које производе хидроксиле потребне за неутрализацију киселих једињења су: пиридин, метиламин и калијум хидроген фосфат.
Да бисмо сазнали које је једињење најефикасније, посматрамо константе равнотеже: што је већа константна вредност, већа је концентрација ОХ-.
Тако је водени раствор који садржи супстанцу погодну за ову намену калијум хидроген фосфат, јер је базичнији и ефикасније неутралише киселине.
Да бисте сазнали више, прочитајте ове текстове.:
- јонска равнотежа
- Реакција неутрализације
10. (Енем / 2009) Сапуни су соли дуголанчаних карбоксилних киселина које се користе да би се олакшало, током процеса прања уклањање супстанци слабе растворљивости у води, нпр. уља и масти. Следећа слика представља структуру молекула сапуна.

У раствору, сапунски аниони могу хидролизовати воду и тако формирати одговарајућу карбоксилну киселину. На пример, за натријум стеарат успоставља се следећа равнотежа:

Будући да је настала карбонска киселина слабо растворљива у води и мање ефикасна у уклањању масти, пХ средине мора бити контролисан на такав начин да спречи померање горње равнотеже удесно.
На основу података у тексту тачно је закључити да сапуни делују на начин:
а) Ефикаснији при основном пХ.
б) Ефикаснији код киселог пХ.
ц) Ефикаснији при неутралном пХ.
д) Ефикасан у било ком опсегу пХ.
е) Ефикаснији код киселог или неутралног пХ.
Одговор: а) Ефикаснији при основном пХ.
У приказаном билансу видимо да натријум стеарат у реакцији са водом формира карбоксилну киселину и хидроксил.
Сврха контроле пХ није да се омогући стварање карбоксилне киселине, а то се постиже померањем равнотеже променом концентрације ОХ-.
што више ОХ- у раствору долази до поремећаја на страни производа и хемијски систем реагује трошењем супстанце којој је повећана концентрација, у овом случају хидроксила.
Због тога ће доћи до трансформације производа у реагенсе.
Стога сапуни раде најефикасније при основном пХ, јер вишак хидроксила помера равнотежу улево.
Да је пХ кисео, дошло би до веће концентрације Х.+ то би утицало на равнотежу конзумирањем ОХ- а равнотежа би деловала тако што би произвела више хидроксила, померајући равнотежу улево и производећи више карбоксилне киселине, што није од интереса у представљеном процесу.
Промена хемијске равнотеже
11. (Енем / 2011) Безалкохолна пића све више постају мета јавних здравствених политика. Производи од лепка садрже фосфорну киселину, супстанцу штетну за фиксирање калцијума, минерала који је главна компонента матрице зуба. Каријес је динамичан процес неравнотеже у процесу денталне деминерализације, губитка минерала услед киселости. Познато је да је главна компонента зубне глеђи сол која се назива хидроксиапатит. Сода, због присуства сахарозе, смањује пХ биофилма (бактеријски плак), узрокујући деминерализацију зубне глеђи. Одбрамбеним механизмима пљувачке треба 20 до 30 минута да нормализују ниво пХ, реминерализујући зуб. Следећа хемијска једначина представља овај процес:
 ГРОИСМАН, С. Утицај соде на зубе процењује се без одузимања исхране. Може се наћи у: http://www.isaude.net. Приступљено: 1. маја 2010. (прилагођено).
ГРОИСМАН, С. Утицај соде на зубе процењује се без одузимања исхране. Може се наћи у: http://www.isaude.net. Приступљено: 1. маја 2010. (прилагођено).
С обзиром на то да особа свакодневно конзумира безалкохолна пића, може доћи до процеса деминерализације зуба, због повећане концентрације
а) ОХ–, који реагује са Ца јонима2+, померање равнотеже удесно.
б) Х.+, који реагује са ОХ хидроксилима–, померање равнотеже удесно.
ц) ОХ–, који реагује са Ца јонима2+, померајући равнотежу улево.
д) Х.+, који реагује са ОХ хидроксилима–, померајући равнотежу улево.
е) Ца2+, који реагује са ОХ хидроксилима–, померајући равнотежу улево.
Тачан одговор: б) Х.+, који реагује са ОХ хидроксилима–, померање равнотеже удесно.
Када се пХ смањи, то је зато што се повећала киселост, односно концентрација Х јона+, како се у изјави каже, постоји присуство фосфорне киселине.
Ови јони реагују са ОХ- узрокујући да се ова супстанца потроши и, сходно томе, помери равнотежу удесно, јер систем делује тако што производи више ових уклоњених јона.
Промена равнотеже између реактаната и производа настала је услед смањења концентрације ОХ-.
Ако Ца јони2+ и ох- да се концентрација повећала, померало би равнотежу улево, јер би систем реаговао трошећи их и формирајући више хидроксиапатита.
Промена претходног биланса, повезаног са цурењем расхладног флуида под описаним условима, резултира:
а) Отпуштање ЦО2 за животну средину.
б) Подизање температуре посуде.
ц) Повишење унутрашњег притиска контејнера.
г) Повишење концентрације ЦО2 у течности.
д) Стварање значајне количине Х.2О.
Тачан одговор: а) испуштање ЦО2 за животну средину.
Унутар бочице угљен-диоксид је растворен у течности због високог притиска.
Када се бочица отвори, притисак унутар посуде (који је био већи) једнак је притиску у околини и, уз то, долази до изласка угљен-диоксида.
Промена равнотеже између реактаната и производа настала је услед смањења притиска: када се притисак смањи, равнотежа се помера на највећи волумен (број молова).
Реакција се померила улево и ЦО2 који је растворен у течности пуштен је исцуривши при отварању бочице.