Rovnako ako cyklány, alkény, alkíny, medzi inými aj alkadiéni tiež trpieť hovory adičné reakcie. V texte o reakcie v diienoch, zistíte, že adičné reakcie závisia od typu diény, na ktorej sa pracuje. Dienes možno zhruba rozdeliť do:
kondenzované alebo akumulované (žiadna jednoduchá väzba medzi dvoma dvojitými);
Pr.: H2C = CH-CH3
konjugované alebo striedané (medzi dvoma dvojitými iba jedno puto);
Pr.: H2C = CH-CH = CH2
izolovaný (aspoň dve jednoduché väzby medzi dvoma dvojitými).
Pr.: H2C = CH-CH2—CH2-CH = CH2
Diels-Alderova reakcia vyvinuli v roku 1928 dvaja nemeckí chemici Otto Paul Hermann Diels a Kurt Alder. Toto je veľmi dôležitá reakcia v rámci organickej chémie, pretože umožňuje:
identifikovať uhľovodíky v diéne;
získať nasýtené cyklické uhľovodíky (výhodne cyklohexány).
Táto organická reakcia sa vyskytuje iba v alkadiény alebo konjugované alebo striedané diény a je tzv doplnok 1.4. Zlúčeninou, v ktorej môžeme jednoduchšie sledovať prídavok 1,4, je but-1,3-dién, ktorý je uvedený nižšie:
H2C = CH-CH = CH2
POZNÁMKA: V tejto zlúčenine máme výskyt fenomén rezonancie, v ktorom sa elektróny z dvoch väzieb pí pohybujú reťazcom. Pár pi elektróny začne obsadzovať centrálnu oblasť reťazca (medzi uhlíkmi 2 a 3), zatiaľ čo elektróny z druhej väzby pí sú posunuté k jednému z koncových uhlíkov. Takže máme väzbové miesta na uhlíkoch 1 a 4 a dvojnásobok medzi uhlíkmi 2 a 3.

Rezonancia v štruktúre but-2,3-diénu
O Diels-Alderova reakcia, jedným z činidiel je konjugovaný dién, zatiaľ čo druhým je organická zlúčenina, ktorá sa môže vyskytovať hovor dvojnásobok medzi atómami uhlíka. Nižšie je uvedený príklad a Diels-Alderova reakcia medzi but-2,3-diénom a propénom:
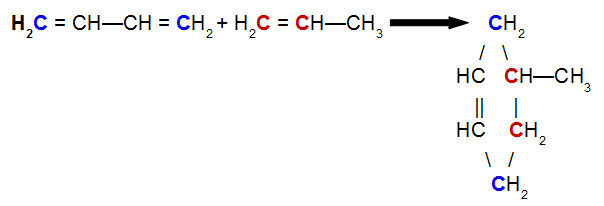
Rovnica Diels-Alderovej reakcie but-2,3-diénu s propénom
Pri analýze vyššie uvedenej rovnice vidíme, že uhlíky 1 a 4 (obidve modro) but-2,3-diénovej väzby na uhlíky 1 a 2 (oba červené) propénu, čo vedie k rozvetvenému cyklénu, 4-metyl-cyklohexén. Je to spôsobené rezonanciou v molekule but-2,3-diénu, ktorá posúva väzbu pí medzi uhlíkmi 2 a 3, a zlomením väzby pí medzi uhlíkmi 1 a 2 propénu.
OBS.²: Je dôležité zdôrazniť, že bez ohľadu na zlúčeninu, ktorá reaguje s konjugovaným alkadiénom, dôjde k prerušeniu väzby pí iba medzi atómami uhlíka v reťazci. Ak má štruktúra pi väzby medzi atómami inými ako uhlík, nerozbijú sa. Ďalej uvádzame príklad štruktúry, ktorá môže reagovať s a alkadién v Diels-Alderova reakcia, čo má za následok prerušenie väzby pí medzi uhlíkmi (modrou farbou) dvojitej väzby.
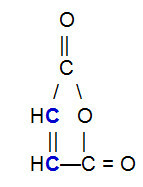
Štruktúrny vzorec anhydridu kyseliny maleínovej
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm

