Hlavné anorganické funkcie sú: kyseliny, zásady, soli a oxidy.
Anorganické zlúčeniny majú rôzne vlastnosti a sú prítomné v mnohých situáciách v našom každodennom živote. Z tohto dôvodu sa táto téma veľa diskutuje na prijímacích skúškach, na Enem a na súťažiach.
Aby sme vám pomohli pripraviť sa na skúšky, vytvorili sme tento zoznam 15 otázok s komentovanými uzneseniami a rôznymi prístupmi pre každú anorganickú funkciu.
Všeobecné pojmy
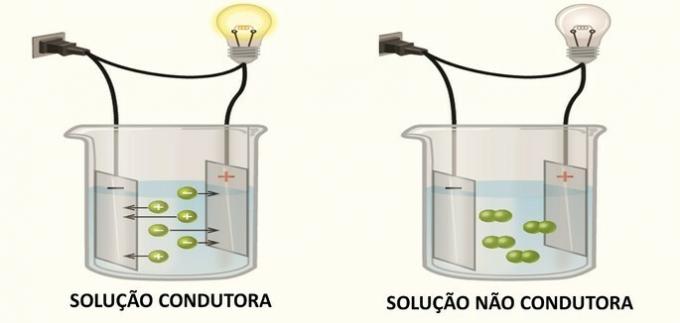
1. (FGV) Niektoré zlúčeniny po rozpustení vo vode vytvárajú vodný roztok, ktorý vedie elektrinu. Z nasledujúcich zlúčenín:
| I. O2IBA4 |
| II. O2 |
| III. Ç12H22O11 |
| IV. KNO3 |
| V. CH3COOH |
| PÍL. NaCl |
Tvoria vodný roztok, ktorý vedie elektrinu:
a) iba ja, IV a VI
b) iba I, IV, V a VI
c) všetky
d) iba ja a VI
e) iba videl
Správna alternatíva: b) iba I, IV, V a VI.
Vedenie elektriny v roztoku nastáva v dôsledku tvorby elektricky nabitých druhov, iónov, ako zistil Arrhenius vo svojich experimentoch.

Keď sa v roztoku vytvoria ióny, katióny (kladný náboj) migrujú k zápornému pólu a aniónom (záporný náboj) migrujú na kladný pól, uzavrú elektrický obvod a umožnia priechod reťaz.
Zlúčeniny, ktoré v roztoku generujú neutrálne druhy, nevodia elektrinu.
Podľa týchto informácií musíme:
I. JAZDU
V roztoku sa soľ disociuje a tvoria sa ióny.
II. NEVIEDA
Diatomický kyslík pri izbovej teplote je inertná molekula.
III. NEVIEDA
Prezentovaný vzorec je zo sacharózy, molekulárnej zlúčeniny, ktorej molekuly sa pri kontakte s vodou rozptýlia, ale nestratia svoju identitu.
IV. JAZDU
V roztoku sa soľ disociuje a tvoria sa ióny.
V. JAZDU
Kyselina octová je slabá kyselina, ktorá má v roztoku malú ionizovanú časť.
PÍL. JAZDU
V roztoku sa soľ disociuje a tvoria sa ióny.
2. (Mackenzie-SP)
Vyššie uvedená rovnica predstavuje reakciu
a) iónovej disociácie.
b) ktorý má ako reaktant dikyselinu.
c) celkovej ionizácie, za vzniku hydroxóniového katiónu.
d) ionizácie za vzniku fosfidového aniónu.
e) ktorý po úplnej ionizácii produkuje jednomocný anión.
Správna alternatíva: c) úplnej ionizácie za vzniku hydroxóniového katiónu.
Kyselina fosforečná je chemická zlúčenina, ktorá ionizuje pri kontakte s vodou a uvoľňuje H ióny+.
Ionizácia prebieha v troch krokoch:
| Prvý krok | |
| Druhá etapa | |
| tretí krok | |
| súčet krokov |
Katióny (H+) uvoľňované reagujú s vodou za vzniku hydroxónového iónu (H3O+).
Z tohto dôvodu musíme:
a) NESPRÁVNE. K disociácii dochádza v iónových zlúčeninách a kyselina fosforečná je molekulárna zlúčenina.
b) NESPRÁVNE. Kyselina fosforečná je triacid, pretože má tri ionizovateľné vodíky.
c) SPRÁVNE. Hydroxóniový katión, tiež nazývaný hydrónium, je druh, ktorý vzniká spojením ionizovateľného vodíka s vodou.
d) NESPRÁVNE. Vyrábaným aniónom je fosfát (). Fosfidový vzorec je:
e) NESPRÁVNE. Vytvorený anión () je trojmocný, pretože má 3 náboje.
3. Správne spojte nasledujúce zlúčeniny s ich príslušnými anorganickými funkciami.
| I. HBr, H3PRACH4 a H2CO3 | () kyseliny |
| II. CO2, IBA2 a Al2O3 | () základy |
| III. Al2(OH)3, KOH a NH4oh | () soli |
| IV. NaCℓ, KNO3 a BaSO4 | () oxidy |
Kyseliny sú zlúčeniny, ktoré majú ionizovateľné vodíky.
(Ja) kyseliny: HBr, H3PRACH4 a H2CO3
Bázy majú hydroxylový ión.
(III) základy: Al2(OH)3, KOH a NH4oh
Soli sú iónové zlúčeniny tvorené katiónmi a aniónmi.
(IV) soli: NaCℓ, KNO3 a BaSO4
Oxidy sú zlúčeniny tvorené spojením kyslíka s inými prvkami, okrem fluóru.
(II) oxidy: CO2, IBA2 a Al2O3
Kyseliny
4. Napíšte názov nasledujúcich kyselín:
a) HCl a HBr
Kyselina chlorovodíková a kyselina bromovodíková.
Vyššie uvedené zlúčeniny predstavujú hydráty. Kyseliny v tejto triede majú vzorec HXA, kde x predstavuje počet vodíkov (H) a A zodpovedá viazanému nekovu.
Nomenklatúra týchto látok sa uvádza takto:
| H | Cl | |
| Kyselina | Chlór | hydric |
| Kyselina chlorovodíková |
| H | br | |
| Kyselina | Brom | hydric |
| kyselina bromovodíková |
b) HNO3 a HNO2
Kyselina dusičná a kyselina dusitá.
Vyššie uvedené zlúčeniny predstavujú kyslé kyseliny s dvoma oxidačnými číslami. Kyseliny v tejto triede majú vzorec HXAO, ktorý je tvorený vodíkom, nekovmi a kyslíkom.
Nomenklatúra týchto látok sa uvádza takto:
| H | N | O3 |
| Kyselina | Nitr | ich |
| Kyselina dusičná. NOx dusíka v tejto zlúčenine je +5. |
Najnižšou zlúčeninou Nox je kyselina dusitá: HNO2.
| H | N | O2 |
| Kyselina | Nitr | kosť |
| Kyselina dusitá. NOx dusíka v tejto zlúčenine je +3. |
c) HClO, HClO2, HClO3 a HClO4
Kyseliny chlórne, chlórne, chlórové a chloristé.
Vyššie uvedené zlúčeniny predstavujú oxykyseliny so štyrmi oxidačnými číslami. Kyseliny v tejto triede majú vzorec HXAO, ktorý je tvorený vodíkom, kyslíkom a nekovom rodiny 7A.
Nomenklatúra týchto látok sa uvádza takto:
| Nox +1 | Kyselina | hroch | predpona prvku | kosť |
| Nox +3 | Kyselina | - | predpona prvku | kosť |
| Nox +5 | Kyselina | - | predpona prvku | ich |
| Nox +7 | Kyselina | za | predpona prvku | ich |
Zlúčeniny uvedené v alternatíve sú pomenované nasledovne:
| H | Cl | O | |
| Kyselina | hroch | chlór | kosť |
| Kyselina chlórna. Hodnoty NOx chlóru v tejto zlúčenine sú +1. |
| H | Cl | O2 |
| Kyselina | chlór | kosť |
| Kyselina chlórová. Hodnoty NOx chlóru v tejto zlúčenine sú +3. |
| H | Cl | O3 |
| Kyselina | chlór | ich |
| Kyselina chlórová. NOx chlóru v tejto zlúčenine je +5. |
| H | Cl | O4 | |
| Kyselina | za | chlór | ich |
| Kyselina chloristá. NOx chlóru v tejto zlúčenine je +7. |
5. (UVA-CE) HClO kyseliny4, H2MnO4, H3PRACH3, H4Sobota2O7, pokiaľ ide o počet ionizovateľných vodíkov, možno rozdeliť na:
a) monokyselina, dikyselina, triacid, tetraacid.
b) monokyselina, dikyselina, triacid, triacid.
c) monokyselina, dikyselina, dikyselina, tetrakyselina.
d) monoacid, monoacid, diacid, triacid.
Správna alternatíva: c) monokyselina, dikyselina, dikyselina, tetrakyselina.
Ionizácia prítomných kyselín nastáva nasledovne:
Štrukturálne vzorce nám ukazujú, že ionizovateľné vodíky sú viazané na kyslík.

Podľa množstva ionizovateľných vodíkov možno kyseliny rozdeliť na:
| HClO4 | ionizovateľný vodík | monokyselina |
| H2MnO4 | Dva ionizovateľné vodíky | dikyselina |
| H3PRACH3 | Dva ionizovateľné vodíky | dikyselina |
| H4Sobota2O7 | Štyri ionizovateľné vodíky | tetracid |
Čo sa týka kyslíkových kyselín, ionizovateľné vodíky sú tie, ktoré sú priamo viazané na kyslík. Kyselina fosforitá má jeden zo svojich troch vodíkov pripojených k centrálnemu prvku, fosforu, a je teda dikyselinou.
6. (UESPI) Ďalej nech sú uvedené kyseliny, s ich príslušnými stupňami ionizácie v percentách (α%):
|
HClO4 (α% = 97%) |
H2IBA4 (α% = 61%) |
H3BO3 (α% = 0,025%) |
H3PRACH4 (α% = 27%) |
HNO3 (α% = 92%) |
Skontrolujte správne vyhlásenie:
a) H3PRACH4 je silnejšia ako H2IBA4.
b) HNO3 je to mierna kyselina.
c) HClO4 je slabší ako HNO3.
d) H3PRACH4 je to silná kyselina.
e) H3BO3 je to slabá kyselina.
Správna alternatíva: e) H3BO3 je to slabá kyselina.
Hodnota zodpovedá stupňu ionizácie a počíta sa z:
Čím vyššia je hodnota , čím je kyselina silnejšia, pretože to znamená, že sa do roztoku dostalo viac ionizovaných druhov.
Z tohto dôvodu musíme:
a) NESPRÁVNE. Čím vyššia je hodnota , tým silnejšia je kyselina. H2IBA4 má vyšší stupeň ionizácie ako H3PRACH4.
b) NESPRÁVNE. HNO3 má stupeň ionizácie vyšší ako 90%. Je to silná kyselina.
c) NESPRÁVNE.4 má vyšší stupeň ionizácie ako HNO3 byť preto silnejším ako on.
d) NESPRÁVNE. H3PRACH4 je to mierna kyselina, pretože má stupeň ionizácie medzi 5% a 50%.
e) SPRÁVNE. H3BO3 má stupeň ionizácie menej ako 5%, a preto je slabou kyselinou.
Bázy
7. Zadajte názov nasledujúcich báz:
a) LiOH a Be (OH)2
Hydroxid lítny a hydroxid berylnatý.
Predkladané bázy majú pevný poplatok, a preto sa nomenklatúra zostavuje takto:
LiOH: hydroxid lítny.
Byť (OH)2: hydroxid berylnatý.
b) CuOH a Cu (OH)2
Hydroxid meďný a hydroxid meďnatý.
Meď má dve oxidačné čísla: +1 a +2. Jedným zo spôsobov, ako pomenovať základňu variabilných nox, je tento:
| Nox +1 | CuOH | hydroxid meďný |
| Nox +2 | Cu (OH)2 | hydroxid meďnatý |
c) Sn (OH)2 a Sn (OH)4
Hydroxid cínatý a hydroxid cínatý.
Cín má dve oxidačné čísla: +2 a +4. Nomenklatúru variabilného základu nox možno vykonať aj takto:
| Nox +2 | Sn (OH)2 | Hydroxid cínu II |
| Nox +4 | Sn (OH)4 | Hydroxid cínu IV |
8. (Fiam-SP) Na potlačenie kyslosti žalúdka spôsobenej prebytkom kyseliny chlorovodíkovej je obvyklé prehltnúť antacidum. Z nižšie uvedených látok, ktoré sa nachádzajú v každodennom živote ľudí, sú na boj proti kyslosti najvhodnejšie:
a) sóda.
b) pomarančový džús.
c) voda s citrónom.
d) ocot.
e) magnéziové mlieko.
Správna alternatíva: e) magnéziové mlieko.
Antacidá sú látky používané na zvýšenie pH žalúdka, pretože prebytok kyseliny chlorovodíkovej spôsobuje zníženie pH a následne zvýšenie kyslosti.
Na boj proti kyslosti žalúdka sa odporúča požiť a látka základného charakteru, pretože pri reakcii so žalúdočnou kyselinou spôsobí neutralizačnú reakciu a vytvorí soľ a vodu.
Z tohto dôvodu musíme:
a) NESPRÁVNE. Sóda sa nemôže použiť, pretože obsahuje vo svojom zložení kyselinu uhličitú.
b) NESPRÁVNE. Pomaranč nemožno použiť, pretože obsahuje vo svojom zložení kyselinu citrónovú.
c) NESPRÁVNE. Citrón nemožno použiť, pretože obsahuje vo svojom zložení kyselinu citrónovú.
d) NESPRÁVNE. Ocot sa nemôže použiť, pretože vo svojom zložení obsahuje kyselinu octovú.
e) SPRÁVNE. Malo by sa použiť magnéziové mlieko, pretože vo svojom zložení obsahuje bázu hydroxidu horečnatého.
Vytvorená neutralizačná reakcia je:
9. (Osec) Silná zásada sa musí viazať na skupinu OH-:
a) veľmi elektropozitívny prvok.
b) veľmi elektronegatívny prvok.
c) polmetal.
d) kov, ktorý dáva 3 elektróny.
e) nekovový.
Správna alternatíva: a) veľmi elektropozitívny prvok.
Silná zásada je taká, ktorá má vysoký stupeň disociácie, to znamená voľné hydroxylové ióny v roztoku.
Hydroxylový ión má negatívny náboj, pretože dokáže priťahovať elektrón k sebe, keď sa disociuje kvôli elektronegativite kyslíka.
Veľmi elektropozitívny prvok má teda schopnosť stratiť elektróny a odovzdať ich hydroxylu, ktorý zostáva v roztoku v katiónovej forme.
a) SPRÁVNE. Veľmi elektropozitívne prvky, ako sú alkalické kovy a kovy alkalických zemín, tvoria silné zásady.
b) NESPRÁVNE. Prvok elektronegatívnejší ako kyslík by spôsobil, že dôjde k súťaži o elektrón.
c) NESPRÁVNE. Semimetal má veľkú elektronegativitu.
d) NESPRÁVNE. Hydroxylový ión má 1 náboj. kov, ktorý dáva 3 elektróny, by vytvoril bázu s 3 hydroxylami.
Príklad:
e) NESPRÁVNE. Najsilnejšie bázy sú bázy tvorené kovmi.
soli
10. Napíšte názov nasledujúcich solí:
a-N-A2CO3
Uhličitan sodný.
Toto je typ neutrálnej soli a jej nomenklatúra je uvedená nasledovne:
| anión | katión |
| O+ | |
| uhličitan | sodík |
| Uhličitan sodný |
b) KNaSO4
Síran sodný a draselný.
Toto je druh dvojitej soli a jej nomenklatúra je rovnaká ako neutrálna soľ. Názvy týchto dvoch katiónov sú napísané.
| anión | katióny | |
| K+ | O+ | |
| Síran | draslík | sodík |
| Síran sodný a draselný |
c) NaHCO3
Monohydrogenuhličitan sodný.
Toto je druh kyslej soli a jej nomenklatúra je uvedená nasledovne:
| Počet vodíkov | anión | katión |
| 1 | O+ | |
| Mono | uhličitan | sodík |
| Monohydrogenuhličitan sodný |
Populárnym názvom tejto zlúčeniny je hydrogenuhličitan sodný.
d) Al (OH)2Cl
Dihydroxychlorid hlinitý.
Toto je druh zásaditej soli a jej nomenklatúra sa uvádza takto:
| Počet hydroxylových skupín | anión | katión |
| 2 | Cl- | Al3+ |
| Di | chlorid | hliník |
| Dihydroxychlorid hlinitý |
Táto zlúčenina je tiež známa ako dvojsýtny chlorid hlinitý.
e) CuSO4. 5 hodín2O
Pentahydrát síranu meďnatého.
Toto je typ hydratovanej soli a jej nomenklatúra je uvedená nasledovne:
| anión | katión | počet molekúl vody |
| Ass2+ | 5 | |
| Síran | meď | penta |
| Pentahydrát síranu meďnatého |
11. (Unirio) Soli sú tiež produkty získané reakciou úplnej alebo čiastočnej neutralizácie ionizovateľných vodíkov kyselín pomocou zásad alebo hydroxidov podľa všeobecnej reakcie:
Kyselina + báza Soľ + Voda
Na základe tohto tvrdenia, ktorá je jediná kyselina, ktorá nemá všetky súvisiace produkty?
a) kyselina chlorovodíková produkuje iba neutrálnu chloridovú soľ.
b) dusičná látka produkuje iba dusičnanovo neutrálnu soľ.
c) fosforečná produkuje iba neutrálnu fosfátovú soľ.
d) sulfid môže produkovať buď neutrálnu sulfidovú soľ alebo kyslú soľ, sulfid kyseliny alebo sírovodík.
e) kyselina sírová môže produkovať buď neutrálnu síranovú soľ, alebo kyslú soľ, kyslý síran alebo hydrogénsíran.
Nesprávna alternatíva: c) fosforečná produkuje iba neutrálnu fosfátovú soľ.
a) SPRÁVNE. Kyselina chlorovodíková má iba jeden ionizovateľný vodík, ktorý bude reagovať na vodu. Soľ potom bude tvorená aniónom kyseliny, v tomto prípade chloridom, a katiónom zásady.
Príklady:
b) SPRÁVNE. Kyselina dusičná má iba jeden ionizovateľný vodík, ktorý bude reagovať za vzniku vody. Soľ potom bude tvorená aniónom kyseliny, v tomto prípade dusičnanom, a katiónom zásady.
Príklady:
c) NESPRÁVNE. Kyselina fosforečná má tri ionizovateľné vodíky, a preto môže byť čiastočne alebo úplne ionizovaná. V takom prípade môžu byť pripravené tri typy solí:
- Celková neutralizácia generujúca a neutrálna soľ:
- Čiastočná neutralizácia generujúca a kyslá soľ:
- Čiastočná neutralizácia generujúca a zásaditá soľ:
d) SPRÁVNE. Pri úplnej neutralizácii vzniká neutrálna soľ a pri čiastočnej neutralizácii kyslá soľ.
- Celková neutralizácia:
- Čiastočná neutralizácia:
e) SPRÁVNE. Pri úplnej neutralizácii vzniká neutrálna soľ a pri čiastočnej neutralizácii kyslá soľ.
- Celková neutralizácia:
- Čiastočná neutralizácia:
| I. O2B4O7.10h2O | THE. zásaditá soľ |
| II. Mg (OH) Cl | B. dvojitá soľ |
| III. NaKSO4 | Ç. kyslá soľ |
| IV. NaHCO3 | D. hydratovaná soľ |
Správna asociácia medzi nimi je:
a) AI, BIII, CIV, DII
b) AII, BIV, CIII, DI
c) AI, BII, CIII, DIV
d) AII, BIII, CIV, DI
Správna alternatíva: d) AII, BIII, CIV, DI
| AII. bázická soľ: Mg (OH) Cl | Vo svojej štruktúre má hydroxylovú skupinu. |
| BIII. dvojitá soľ: NaKSO4 | Vo svojej štruktúre má dva kovové katióny. |
| CIV. kyslá soľ: NaHCO3 | Vo svojej štruktúre má vodík. |
| DI. hydratovaná soľ: Na2B4O7.10h2O | Vo svojej štruktúre má molekuly vody. |
Oxidy
13. Napíšte názov nasledujúcich oxidov:
oceľ2 a nie2O3
Oxid uhličitý a oxid dusný.
Tieto oxidy sú molekulárne oxidy, pretože kyslík sa viaže na nekovy. Nomenklatúra pre túto triedu sa vykonáva takto:
| počet kyslíkov | Počet uhlíkov |
| 2 | 1 |
| Oxid uhličitý alebo oxid uhličitý |
| počet kyslíkov | Počet dusíkov |
| 3 | 2 |
| oxid dusný |
b) Al2O3 a ďalej2O
Oxid hlinitý a oxid sodný.
Tieto oxidy sú oxidy iónov, pretože kyslík sa viaže na kovy. Kovy viazané na kyslík majú pevný náboj. Nomenklatúra tejto triedy sa preto vykonáva takto:
Al2O3: oxid hlinitý
O2O: oxid sodný
b) Cu2O a CuO
Oxid meďnatý I a oxid meďnatý II.
Tieto oxidy sú iónové oxidy, pretože kyslík je viazaný na kov. Kov viazaný na kyslík má premenlivý náboj. Jedným zo spôsobov, ako túto triedu pomenovať, je:
| Nox +1 | Ass2O | oxid meďnatý I |
| Nox +2 | CuO | oxid meďnatý II |
c) FeO a Fe2O3
Oxid železitý a oxid železitý.
Tieto oxidy sú iónové oxidy, pretože kyslík je viazaný na kov. Kov viazaný na kyslík má premenlivý náboj. Nomenklatúru premenného oxidu noxu je možné vykonať aj takto:
| Nox +2 | FeO | oxid železnatý |
| Nox +3 | Viera2O3 | oxid železitý |
14. (UEMA) Neutrálne atómy určitého reprezentatívneho prvku M majú vo svojej valenčnej škrupine dva elektróny. Správne vzorce pre normálny oxid a bromid sú:
(Údaje: O = 6A a Br = 7A.)
a) M2O a MBr
b) MO2 a MBr2
c) MO a MBr2
d) M2O2 v2br
v2O a MBr2
Správna alternatíva: c) MO a MBr2
M prvky majú vo valenčnej škrupine dva elektróny. Pri väzbe s ďalšími prvkami môže stratiť tieto dva elektróny a vytvoriť katión M.2+.
Kyslík patrí do rodiny 6A a na získanie stability s elektronickou konfiguráciou vzácneho plynu potrebuje ďalšie 2 elektróny, ako stanovuje pravidlo oktetu.
Rovnako bróm, ktorý je z rodiny 7A, potrebuje iba 1 elektrón, aby mohol mať vo valenčnej škrupine 8 elektrónov.
Podľa týchto informácií musíme:
a) NESPRÁVNE. Za vzniku zlúčeniny M2O a MBr, prvok M by mal tvoriť katión M.+.
b) NESPRÁVNE. Kyslík má 2- a nie 1- náboj, ako je znázornené pri tvorbe MO zlúčeniny2.
c) SPRÁVNE. Podľa valencie iónov je alternatíva správna.
d) NESPRÁVNE. Bromid má 1- a nie 2- náboj, ako je uvedené pri príprave zlúčeniny M2Br.
e) NESPRÁVNE. Katión prvku má náboj 2+ a nie náboj 1+, ako je znázornené pri vytváraní zlúčeniny M.2O.
15. (PUC-MG) Sledujte nižšie uvedené chemické reakcie:
| I. MgO + H2O |
| II. CO2 + H2O |
| III. K2O + 2HCI |
| IV. IBA3 + 2NaOH |
Nesprávne tvrdenie je:
a) Reakcie II a IV zahŕňajú oxidy alebo anhydridy kyselín.
b) Reakcie I a III zahŕňajú bázické oxidy.
c) Soľ vyrobená v reakcii IV sa nazýva síran sodný.
d) Soľ vyrobená v reakcii III sa nazýva chlorid draselný.
e) Základný charakter oxidov sa zdôrazňuje, pretože kyslík sa viaže na elektronegatívne prvky.
Nesprávna alternatíva: e) Základný charakter oxidov stúpa, keď sa kyslík viaže na elektronegatívne prvky.
a) SPRÁVNE. Keď kyslé oxidy, ako je oxid uhličitý a oxid sírový, reagujú s vodou, vytvárajú v roztoku kyselinu.
b) SPRÁVNE. Pri reakcii s vodou tvoria zásadité oxidy, ako je oxid horečnatý a oxid draselný, v roztoku bázu.
c) SPRÁVNE. O2IBA4 je vzorec pre síran sodný.
d) SPRÁVNE. KCl je vzorec pre chlorid draselný.
e) NESPRÁVNE. Základný charakter oxidov sa zdôrazňuje, pretože kyslík sa viaže na viac prvkov. elektropozitívneako alkalické kovy a kovy alkalických zemín, pretože pri reakcii s vodou vytvárajú silné zásady a pri reakcii s kyselinami tvoria soľ a vodu.