Chemická rovnováha je jedným z predmetov, ktoré najviac spadajú na Enem a prijímacie skúšky.
Otázkam sa venujú aspekty reverzibilných reakcií a kandidáti sú hodnotení jednak výpočtami, jednak koncepciami, ktoré zahŕňajú túto tému.
Z tohto dôvodu sme vytvorili tento zoznam otázok s rôznymi prístupmi k chemickej rovnováhe.
Využite pripomienky k uzneseniu na prípravu na skúšky a pozrite si podrobné pokyny na riešenie otázok.
Všeobecné pojmy chemickej rovnováhy
1. (Uema) V rovnici , po dosiahnutí chemickej rovnováhy môžeme uzavrieť rovnovážnu konštantu
, o ktorom je správne uviesť, že:
a) čím vyššia je hodnota Kc, tým nižší je výťažok priamej reakcie.
b) K.ç bez ohladu na teplotu.
c) ak sú rýchlosti doprednej a inverznej reakcie rovnaké, potom Kc = 0.
d) K.ç Závisí to od počiatočných podobností reaktantov.
e) čím vyššia je hodnota Kc, tým vyššia je koncentrácia produktov.
Správna odpoveď: e) čím vyššia je hodnota Kc, tým vyššia je koncentrácia produktov.
Priama reakcia je predstavovaná číslom 1, kde:
Inverznú reakciu predstavuje
Hodnota Kç Vypočíta sa pomerom medzi koncentráciami produktov a činidiel.
Čitateľ (ktorý obsahuje produkty) je priamo úmerný rovnovážnej konštante. Preto čím vyššia je hodnota Kç, čím vyšší je výťažok priamej reakcie, pretože sa vytvára viac produktu, a tým aj vyššia koncentrácia produktov.
Hodnota Kç sa mení s teplotou, pretože keď zmeníme jej hodnotu, môže byť endotermická (absorpcia tepla) alebo exotermická (uvoľnenie tepla) a tým sa môže spotrebovať alebo vytvoriť viac činidla alebo produktu, čím sa zmení rovnovážna konštanta, ktorá závisí od koncentrácie činidlá.
Kc závisí od molárnych množstiev zložiek, keď sa dosiahne rovnováha a kedy sú rýchlosti doprednej a reverznej reakcie rovnaké.
2. (UFRN) Chemická rovnováha sa vyznačuje tým, že je dynamická na mikroskopickej úrovni. Na získanie kvantitatívnych informácií o rozsahu chemickej rovnováhy sa používa rovnovážna konštantná veličina. Zvážte nasledujúci prúžok:

Aplikovaná na chemickú rovnováhu, predstava postavy o rovnováhe:
a) Je to správne, pretože v chemickej rovnováhe sú polovičné množstvá vždy produkty a druhá polovica reaktanty.
b) Nie je to správne, pretože v chemickej rovnováhe môžu byť koncentrácie produktov a reaktantov odlišné, ale sú konštantné.
c) Je to správne, pretože v chemickej rovnováhe sú koncentrácie reaktantov a produktov vždy rovnaké, pokiaľ rovnováha nie je narušená vonkajším účinkom.
d) Nie je správne, pretože v chemickej rovnováhe sú koncentrácie produktov vždy vyššie ako v reaktantoch, pokiaľ rovnováha nie je ovplyvnená vonkajším faktorom.
e) Je to správne, pretože v chemickej rovnováhe nie sú koncentrácie reaktantov a produktov vždy rovnaké.
Správna odpoveď: b) Nie je to správne, pretože v chemickej rovnováhe môžu byť koncentrácie produktov a reaktantov rôzne, sú však konštantné.
V rovnováhe možno vypočítať množstvá produktov a činidiel na základe konštanty rovnováha a nemuselo by to byť nevyhnutne polovičné množstvo výrobkov a druhá polovica činidlá.
Rovnovážné koncentrácie nie sú vždy rovnaké, môžu byť odlišné, ale konštantné, ak v rovnováhe nenastanú žiadne poruchy.
Rovnovážné koncentrácie by mali závisieť od toho, ktorá reakcia je uprednostňovaná, či už priama alebo inverzná. Môžeme to poznať podľa hodnoty Kç: ak Kç 1, Priama reakcia je uprednostnená. už keby Kç
1 je uprednostnená opačná reakcia.
Grafy chemickej rovnováhy
3. (UFPE) Na začiatku 20. storočia vyvolalo očakávanie prvej svetovej vojny veľkú potrebu zlúčenín dusíka. Haber bol priekopníkom výroby amoniaku z dusíka vo vzduchu. Ak je amoniak umiestnený v uzavretej nádobe, rozkladá sa podľa nasledujúcej nevyváženej chemickej rovnice: NH3g) → N2 písm. G) + H2 písm. G). Zmeny koncentrácií v priebehu času ilustruje nasledujúci obrázok:

Z analýzy obrázku vyššie môžeme konštatovať, že krivky A, B a C predstavujú časovú zmenu koncentrácií nasledujúcich reakčných zložiek:
a) H2, č2 a NH3
b) NH3, H2 a nie2
c) NH3, č2 a H2
d) Nie2, H2 a NH3
e) H2, NH3 a nie2
Správna odpoveď: d) N2, H2 a NH3.
1. krok: vyvážte chemickú rovnicu.
2 NH3g) → N2 písm. G) + 3 H2 písm. G)
Pri vyváženej reakcii sme si uvedomili, že na rozloženie na dusík a vodík sú potrebné 2 móly amoniaku. Tiež množstvo vodíka produkovaného pri reakcii je trikrát väčšie ako množstvo amoniaku.
2. krok: interpretácia údajov grafu.
Ak sa amoniak rozkladá, potom je v jeho grafe jeho koncentrácia maximálna a klesá, ako je zrejmé z krivky C.
Produkty, ktoré sa tvoria, sú na začiatku reakcie nulové a zvyšujú sa, keď sa z reaktantu stane produkt.
Pretože množstvo produkovaného vodíka je trikrát väčšie ako množstvo dusíka, potom je krivka pre tento plyn najväčšia, ako je uvedené v B.
Ďalším tvoreným produktom je dusík, ako je zrejmé z krivky A.
4. (Cesgranrio) Systém predstavovaný rovnicou bol v rovnováhe. Rovnovážny stav sa náhle zmenil pridaním látky G. Systém reaguje na obnovenie rovnováhy. Ktorý z nasledujúcich grafov najlepšie predstavuje zmeny, ku ktorým došlo počas opísaného procesu?
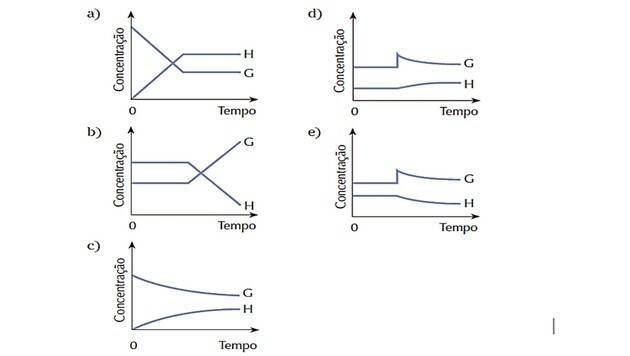
Správna odpoveď: d).

Pretože bol systém na začiatku v rovnováhe, množstvá látok G a H zostali konštantné.
K rušeniu došlo, keď sa zvýšila koncentrácia G a systém reagoval jeho transformáciou reaktant vo väčšom množstve produktu H, posunutie rovnováhy doprava, to znamená zvýhodnenie reakcie priamy.
Pozorujeme, že krivka činidla G klesá, keď sa spotrebúva, a krivka produktu H sa zvyšuje, keď sa vytvára.
Keď sa nastolí nová rovnováha, množstvá sa stanú opäť konštantnými.
Rovnovážna konštanta: vzťah medzi koncentráciou a tlakom
5. (UFRN) S vedomím, že KP = K.ç (RT)n, môžeme povedať, že KP = K.ç, pre:
oceľ2g) + H2 písm. G) ↔ COg) + H2Og)
b) H2 písm. G) + ½2 písm. G) ↔ H2O(1)
c) Nie2 písm. G) + 3 H2 písm. G) ↔ 2 NH3g)
d) NIEg) + ½ O2g) ↔ Č2g)
e) 4 FeSs + 7 O.2 písm. G) ↔ 2 Fe2O3 s + 4 SO2g)
Správna odpoveď: a) CO2g) + H2 písm. G) ↔ COg) + H2Og)
K K.P sa rovná Kç variácia v počte mólov sa musí rovnať nule, pretože akýkoľvek počet zvýšený na nulu vedie k 1:
KP = K.ç (RT)0
KP = K.ç x 1
KP = K.ç
Zmena v počte mólov sa počíta z:
∆n = počet mólov produktov - počet mólov činidiel
Na tomto výpočte sa zúčastňujú iba koeficienty látok v plynnom stave.
Pri použití každej alternatívnej rovnice máme:
| oceľ2g) + H2 písm. G) ↔ COg) + H2Og) | ∆n = [(1 + 1) - (1 + 1)] = 2 - 2 = 0 |
| b) H2 písm. G) + ½2 písm. G) ↔ H2O(1) | ∆n = [0 - (1 + 1/2)] = 0 - 3/2 = - 3/2 |
| c) Nie2 písm. G) + 3 H2 písm. G) ↔ 2 NH3 (g) | ∆n = [2 - (1 + 3)] = 2 - 4 = -2 |
| d) NIEg) + ½2 písm. G) ↔ Č2 písm. G) | ∆n = [1 - (1 + 1/2)] = 1 - 3/2 = - 1/2 |
| e) 4 FeSs + 7 O.2 písm. G) ↔ 2 Fe2O3 s + 4 SO2 písm. G) | ∆n = [(0 + 4) - (0 + 7)] = 4 - 7 = - 3 |
Na základe týchto výsledkov môžeme pozorovať, že alternatívou, ktorej hodnota zodpovedá požadovanému výsledku, je alternatíva v prvej rovnici.
6. (Prispôsobené UEL) Pre reakciu predstavovanú rovnovážné konštanty Kç a K.P sú vyjadrené rovnicami: (dané: p = parciálny tlak)
Správna alternatíva:
Rovnovážna konštanta sa počíta z:
Pevné látky sa kvôli svojim konštantným koncentráciám nepodieľajú na výpočte Kç, preto je rovnovážna konštanta pre danú rovnicu:
Pre rovnovážnu konštantu, pokiaľ ide o tlak, sa na výpočte zúčastňujú iba plyny, takže:
Výpočet rovnovážnej konštanty
7. (Enem / 2015) Niekoľko kyselín sa používa v priemyselných odvetviach, ktoré likvidujú svoje odpadové vody vo vodných útvaroch, ako sú napríklad rieky a jazerá, čo môže mať vplyv na environmentálnu rovnováhu. Na neutralizáciu kyslosti sa môže do odtoku pridávať vo vhodných množstvách soľ uhličitanu vápenatého, pretože produkuje hydrogenuhličitan, ktorý neutralizuje vodu. Uvádzajú sa rovnice zapojené do procesu:
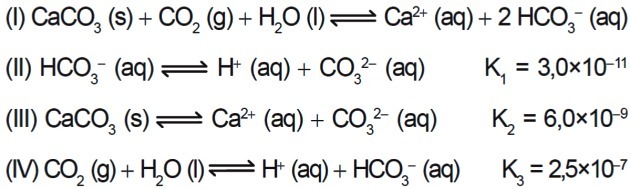
Aká je číselná hodnota rovnovážnej konštanty reakcie I na základe hodnôt rovnovážnych konštánt reakcií II, III a IV pri 25 ° C?
a) 4,5 x 10-26
b) 5,0 x 10-5
c) 0,8 x 10-9
d) 0,2 x 105
e) 2,2 x 1026
Správna odpoveď: b) 5,0 x 10-5
1. krok: pomocou Hessovho zákona vykonajte potrebné úpravy.
Vzhľadom na chemickú rovnicu:
Konštanta sa počíta z:
Ak ale obrátime rovnicu, dostaneme ako výsledok:
A konštanta sa stáva inverznou:
Aby sme sa dostali k rovnici 1 uvedenej v otázke, musíme invertovať rovnicu II, ako v predchádzajúcom príklade.
2. krok: Manipulujte s rovnicami II, III a IV, aby ste sa dostali k výsledku rovnice I.
3. krok: vypočítajte rovnovážnu konštantu rovnice I.
Výpočet K.Ja sa robí vynásobením konštantných hodnôt.
Pretože vo výpočte máme rovnaké sily báz, opakujeme bázu a pridáme exponenty.
Pretože teraz máme delenie s rovnakými mocnosťami báz, opakujeme bázu a odčítame exponenty.
8. (UnB) Chlorid fosforečný je veľmi dôležité činidlo v organickej chémii. Pripravuje sa v plynnej fáze reakciou:
Banka s objemom 3,00 I obsahuje pri rovnováhe pri 200 ° C: 0,120 mol PCl5g), 0,600 mol PCl3g) a 0,0120 mol CL2g). Aká je hodnota rovnovážnej konštanty pri tejto teplote?
Správna odpoveď: 50 (mol / L)-1
1. krok: Zostavte vyjadrenie rovnovážnej konštanty pre reakciu.
2. krok: vypočítajte koncentrácie každej zložky v mol / l pri rovnováhe.
Vzorec pre molárnu koncentráciu:
| PCl3 | Cl2 | PCl5 |
3. krok: nahraďte koncentrácie v konštantnom vyjadrení a vypočítajte hodnotu Kç.
Žiadosti o rovnovážnu rovnováhu
9. (Enem / 2016) Po úplnom opotrebení je možné pneumatiky spáliť, aby sa získala energia. Medzi plynmi generovanými pri úplnom spaľovaní vulkanizovaného kaučuku sú niektoré znečisťujúce látky, ktoré spôsobujú kyslé dažde. Aby sa zabránilo ich úniku do atmosféry, môžu sa tieto plyny prebublávať do vodného roztoku obsahujúceho vhodnú látku. Zvážte informácie o látke uvedené v tabuľke.
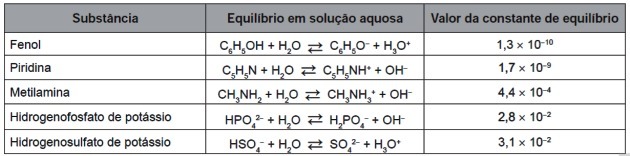
Z látok uvedených v tabuľke je ten, ktorý je schopný najúčinnejšie odstraňovať znečisťujúce plyny, a)
a) Fenol.
b) pyridín.
c) Metylamín.
d) Hydrogénfosforečnan draselný.
e) Hydrogensíran draselný.
Správna odpoveď: d) Hydrogénfosforečnan draselný.
CO2, oxidy síry (SO2 a tak3) a oxidy dusíka (NO a NO2) sú hlavnými znečisťujúcimi plynmi.
Keď reagujú s vodou prítomnou v atmosfére, existuje a tvorba kyselín ktoré spôsobujú zvýšenie kyslosti dažďov, preto sa nazýva kyslý dážď.
Rovnovážné konštanty uvedené v tabuľke sa vypočítajú z pomeru medzi koncentráciami produktov a činidiel takto:
Upozorňujeme, že rovnovážna konštanta je úmerná koncentrácii produktov: čím väčšie je množstvo produktov, tým vyššia je hodnota Kç.
Poznamenajte si hodnoty prvého a posledného zloženého súboru v tabuľke pre Kç:
| pyridín | ||
| Hydrogénsíran draselný |
Pri porovnaní týchto dvoch čísel vidíme, že čím je menšia záporná sila, tým väčšia je hodnota konštanty.
Pre efektívnejšie odstránenie znečisťujúcich látok, OH- reagovať s iónmi H+ prítomné v kyselinách prostredníctvom a neutralizačná reakcia.
Medzi predloženými látkami sú látky, ktoré produkujú hydroxylové skupiny potrebné na neutralizáciu kyslých zlúčenín: pyridín, metylamín a hydrogénfosforečnan draselný.
Aby sme zistili, ktorá zlúčenina je najefektívnejšia, sledujeme rovnovážné konštanty: čím vyššia je konštantná hodnota, tým vyššia je koncentrácia OH-.
Vodným roztokom obsahujúcim látku vhodnú na tento účel je teda hydrogénfosforečnan draselný, pretože je zásaditejší a účinnejšie neutralizuje kyseliny.
Ak sa chcete dozvedieť viac, prečítajte si tieto texty.:
- iónová rovnováha
- Neutralizačná reakcia
10. (Enem / 2009) Mydlá sú soli karboxylových kyselín s dlhým reťazcom používané na uľahčenie, počas prania odstraňovanie látok s nízkou rozpustnosťou vo vode, napr. olejov a tuky. Nasledujúci obrázok predstavuje štruktúru molekuly mydla.
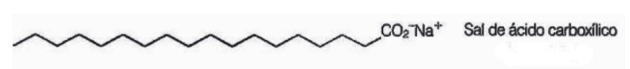
V roztoku môžu mydlové anióny hydrolyzovať vodu a tým vytvárať zodpovedajúcu karboxylovú kyselinu. Napríklad pre stearát sodný sa stanoví táto rovnováha:
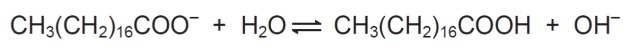
Pretože vytvorená karboxylová kyselina je zle rozpustná vo vode a menej účinná pri odstraňovaní tukov, pH média musí byť regulované takým spôsobom, aby sa zabránilo posunutiu rovnováhy vyššie doprava.
Na základe informácií v texte je správne dospieť k záveru, že mydlá fungujú spôsobom:
a) Účinnejšie pri zásaditom pH.
b) Účinnejšie pri kyslom pH.
c) Účinnejšie pri neutrálnom pH.
d) Účinné v akomkoľvek rozmedzí pH.
e) Účinnejšie pri kyslom alebo neutrálnom pH.
Odpoveď: a) Účinnejšie pri zásaditom pH.
Na zobrazenej bilancii vidíme, že stearát sodný pri reakcii s vodou vytvára karboxylovú kyselinu a hydroxylovú skupinu.
Účelom kontroly pH nie je umožniť tvorbu karboxylovej kyseliny, a to dosiahnutím posunu rovnováhy zmenou koncentrácie OH.-.
tým viac OH- v roztoku dochádza k narušeniu na strane výrobkov a chemický systém reaguje konzumáciou látky, ktorá mala zvýšenú koncentráciu, v tomto prípade hydroxylovej skupiny.
V dôsledku toho dôjde k transformácii produktov na reagencie.
Preto mydlá pracujú najefektívnejšie pri zásaditom pH, pretože prebytok hydroxylu posúva rovnováhu doľava.
Keby bolo pH kyslé, bola by vyššia koncentrácia H+ to by ovplyvnilo rovnováhu konzumáciou OH- a rovnováha by pôsobila tak, že by sa produkovalo viac hydroxylu, posunulo by sa to doľava a produkovalo by sa viac karboxylovej kyseliny, čo v predloženom postupe nie je zaujímavé.
Posun chemickej rovnováhy
11. (Enem / 2011) Nealkoholické nápoje sa čoraz viac stávajú cieľom politík v oblasti verejného zdravia. Lepiace výrobky obsahujú kyselinu fosforečnú, látku škodlivú pre fixáciu vápnika, minerál, ktorý je hlavnou zložkou zubnej matrice. Kaz je dynamický proces nerovnováhy v procese zubnej demineralizácie, straty minerálov v dôsledku kyslosti. Je známe, že hlavnou zložkou zubnej skloviny je soľ nazývaná hydroxyapatit. Sóda v dôsledku prítomnosti sacharózy znižuje pH biofilmu (bakteriálneho plaku) a spôsobuje demineralizáciu zubnej skloviny. Slinným obranným mechanizmom trvá normalizácia hodnoty pH 20 až 30 minút a remineralizácia zuba. Nasledujúca chemická rovnica predstavuje tento proces:
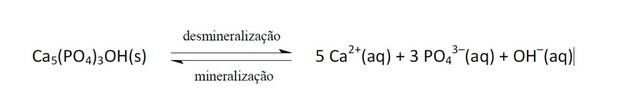 GROISMAN, S. Vplyv sódy na zuby sa hodnotí bez toho, aby bola odobratá z potravy. Dostupné v: http://www.isaude.net. Prístup: 1. mája 2010 (prispôsobené).
GROISMAN, S. Vplyv sódy na zuby sa hodnotí bez toho, aby bola odobratá z potravy. Dostupné v: http://www.isaude.net. Prístup: 1. mája 2010 (prispôsobené).
Ak vezmeme do úvahy, že človek konzumuje nealkoholické nápoje každý deň, môže dôjsť k procesu zubnej demineralizácie v dôsledku zvýšenej koncentrácie
a) OH–, ktorý reaguje s iónmi Ca2+, posun rovnováhy doprava.
b) H+, ktorý reaguje s hydroxylovými skupinami OH–, posun rovnováhy doprava.
c) OH–, ktorý reaguje s iónmi Ca2+, pričom sa rovnováha posúva doľava.
d) H+, ktorý reaguje s hydroxylovými skupinami OH–, pričom sa rovnováha posúva doľava.
e) Ca2+, ktorý reaguje s hydroxylovými skupinami OH–, pričom sa rovnováha posúva doľava.
Správna odpoveď: b) H+, ktorý reaguje s hydroxylovými skupinami OH–, posun rovnováhy doprava.
Keď pH klesá, je to preto, že sa zvýšila kyslosť, to znamená koncentrácia iónov H+, ako sa uvádza vo vyhlásení, je tu prítomnosť kyseliny fosforečnej.
Tieto ióny reagujú s OH- čo spôsobí, že táto látka bude spotrebovaná, a v dôsledku toho dôjde k posunu rovnováhy doprava, pretože systém funguje tak, že produkuje viac týchto odstránených iónov.
K rovnovážnemu posunu medzi reaktantmi a produktmi došlo v dôsledku zníženia koncentrácie OH-.
Ak ióny Ca2+ a oh- ak by sa koncentrácia zvýšila, posunulo by to rovnováhu doľava, pretože systém by reagoval tak, že ich skonzumuje a vytvorí viac hydroxyapatitu.
Výsledkom zmeny predchádzajúcej váhy súvisiacej s únikom chladiva za opísaných podmienok je:
a) uvoľňovanie CO2 pre životné prostredie.
b) Zvýšenie teploty nádoby.
c) Zvýšenie vnútorného tlaku v nádrži.
d) Zvýšenie koncentrácie CO2 v tekutine.
e) Tvorba významného množstva H2O.
Správna odpoveď: a) uvoľnenie CO2 pre životné prostredie.
Vo vnútri fľaše sa oxid uhličitý rozpustil v kvapaline v dôsledku vysokého tlaku.
Po otvorení fľaše sa tlak vo vnútri nádoby (ktorý bol väčší) rovná tlaku v prostredí, a tým dochádza k úniku oxidu uhličitého.
K rovnovážnemu posunu medzi reaktantmi a produktmi došlo v dôsledku zníženia tlaku: keď tlak klesá, rovnováha sa posúva na najväčší objem (počet mólov).
Reakcia sa posunula doľava a CO2 ktorý sa rozpustil v kvapaline, sa uvoľnil a po otvorení fľaše vytekal.
