O princíp Le Chatelier nám hovorí, že keď dôjde k narušeniu rovnovážneho systému, posunie sa smerom, ktorý minimalizuje sily vytvorené týmto narušením, a obnoví novú chemickú rovnováhu.
Jednou z týchto porúch je kolísanie teploty. Táto variácia je dôležitá, pretože okrem spôsobenia rovnovážneho posunu zmení aj hodnotu rovnovážnej konštanty Kç.
Aby ste lepšie pochopili, ako sa to deje, pozrime sa na príklad:
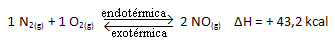
Kç = _[ NA]2___
[N2]. [O.2]
Vyššie uvedená reakcia nastáva v priamom smere s absorpciou energie, je endotermická. Opačný proces na druhej strane nastáva pri uvoľňovaní energie, čo je exotermická reakcia.
Ak teda zvýšime teplotu systému, chemická rovnováha sa posunie smerom k endotermickej reakcii, ktorá je v tejto reakcii doprava. Je to tak, aby sa teplo absorbovalo a znovu sa získala rovnováha.
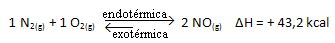
Platí to aj opačne; ak znížime teplotu tohto systému, reakcia sa posunie v smere, v ktorom bude uvoľňovať teplo, pretože sa zníži celková energia reakcie. To znamená, že rovnováha sa posunie smerom k exotermickej reakcii, ktorá je v tomto prípade vľavo:
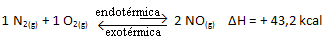
V skratke:

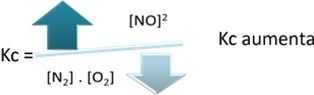
Vo vzťahu k rovnovážnej konštante (K.ç), keď sa teplota zvýši, podporuje endotermnú reakciu a viac dusíkag) vzniká, zvyšuje jeho koncentráciu a znižuje koncentráciu reaktantov. Vo vzorci nižšie si všimnite, že koncentrácia NOg) je priamo úmerná konštante K.ç, preto tiež zvyšuje:
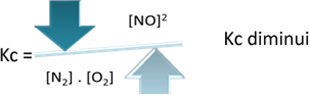
Ale ak znížime teplotu a posunieme reakciu smerom k exotermickej reakcii, koncentrácia NO produktu sa zníži a koncentrácie reaktantov sa zvýšia. Pretože koncentrácie reaktantov sú nepriamo úmerné konštante Kc, potom klesnú:
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm