Niektoré zlúčeniny majú vo svojej štruktúre dvojité väzby striedané s jednoduchými väzbami. Najznámejším zo všetkých je benzén, ktorého štruktúru navrhol v roku 1865 nemecký chemik Friedrich August Kekulé (1829-1896). Jeho štruktúra by bola cyklická a tvorená tromi dvojitými väzbami rozptýlenými tromi jednoduchými väzbami, ako je znázornené na obrázkoch nižšie:
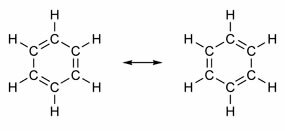
Oba spôsoby vyjadrenia benzénu sú prijateľné, pretože je možné meniť elektróny vo väzbách π bez zmeny polohy atómov. Ani jeden však nepredstavuje presne to, čím je, ani nevysvetľuje svoje správanie. Mal by sa správať ako alkén a vyvolať adičné reakcie, ale v praxi sa to nestane. Benzén je dosť stabilný a správa sa, akoby nemal dvojité väzby; poskytuje substitučné reakcie ako v alkánoch.
V roku 1930 americký vedec Linus Pauling navrhol rezonančnú teóriu, ktorá vysvetlila tento zjavný rozpor. Táto teória povedala:
"Kedykoľvek môžeme v štruktúrnom vzorci zmeniť polohu elektrónov." bez zmeny polohy atómov, skutočná štruktúra č nebude žiadna zo získaných štruktúr, ale skôr a rezonančný hybrid týchto štruktúr. “
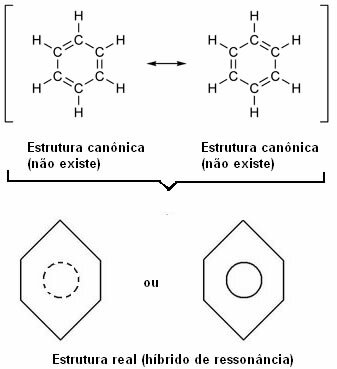
O tomto efekte svedčí veľkosť uhlíkových väzieb a vzdialenosť medzi nimi. Táto vzdialenosť je stredná od vzdialenosti jednoduchej väzby (1,54 Á) a vzdialenosti dvojitej väzby (1,34 Á); je teda 1,39 Å kvôli rezonančnému efektu.
Tento účinok možno pozorovať aj v štruktúre molekuly ozónu (O3), ako je uvedené nižšie:
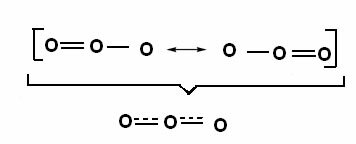
Kanonické štruktúry a ozónové rezonančné hybridy.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Brazílsky školský tím.
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
