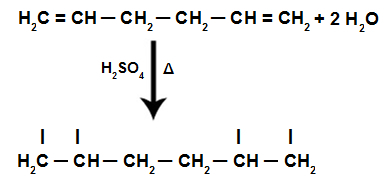
O organické eliminačné reakcie sú tie, v ktorých sú z nej odstránené alebo vylúčené atómy alebo skupiny atómov molekuly, vytvorenie novej organickej zlúčeniny, okrem anorganickej zlúčeniny, ktorá je tvorená časťou, ktorá bola vypúšťa sa
Jedným typom eliminačnej reakcie je dehydratácia, v ktorej je stratenou molekulou voda. Dehydratácia alkoholov (zlúčeniny, ktoré majú skupinu OH pripojenú k nasýtenému uhlíku v otvorenom reťazci) môže prebiehať dvoma spôsobmi: intramolekulárne a intermolekulárne.
„Intra“ znamená „vo vnútri“, preto intramolekulárna dehydratácia alkoholov nastáva, keď molekula vody vystúpi z „vnútra“ samotnej molekuly alkoholu. V tomto prípade bude organickým produktom alkén.
Táto reakcia prebieha iba v prítomnosti katalyzátora, ktorý pôsobí ako vysúšadlo, a väčšinou ide o koncentrovanú kyselinu sírovú (H2IBA4) a teplota by mala byť okolo 170 ° C.
Príklad:
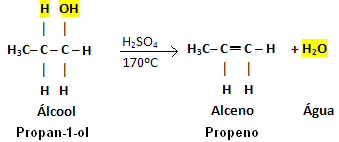
Všimnite si, že skupina OH odišla a vodík opustil susedný uhlík, čo dalo vzniknúť vode. Ďalej sa vytvorila dvojitá väzba, ktorá viedla k vzniku alkénu.
Zariadenie na dehydratáciu sa riadi týmto zostupným poradím:
Terciárne alkoholy> Sekundárne alkoholy> Primárne alkoholy
Čo však s tým, keď skupina OH príde uprostred uhlíkového reťazca? Atóm vodíka, z ktorého sa susedný atóm uhlíka uvoľní a vytvorí molekulu vody?
Teraz neprestávajte... Po reklame je toho viac;)
Napríklad ďalší je 2-metylpentán-3-ol. Jeden susedný atóm uhlíka je terciárny (zvýraznený červenou farbou), zatiaľ čo druhý je sekundárny (zvýraznený modrou farbou):
H OH H
│ │ │
H3C─ Ç ─ Ç ─ Ç CH3
│ │ │
H H CH3
Vodík naviazaný na terciárny atóm uhlíka bude ľahšie opustiť, pretože jeho elektronegatívny charakter sa rovná δ+1Čím je teda uhlík menej negatívny, tým je medzi nimi slabšia väzba a ľahšie sa ich väzba pretrhne.
V prípadoch, ako je tento, sa tvoria všetky možné zlúčeniny, avšak prevaha bude uvedená v poradí: Terciárne alkoholy> Sekundárne alkoholy> Primárne alkoholy.
Takže máme:
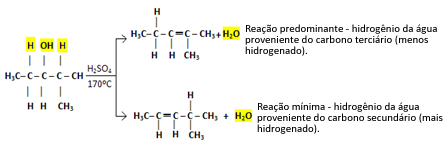
Tento typ reakcie sa riadi Saytzefovo pravidlo, ktorý to hovorí bude mať väčší sklon k tomu, aby vodík zanechával uhlík menej hydrogenovaný. Toto pravidlo je presne opačné Markovnikovovo pravidlo použité na adičné reakcie.
Aby ste si doplnili svoje vedomosti o tejto téme, prečítajte si tiež text „Intermolekulárna dehydratácia alkoholov”.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Intramolekulárna dehydratácia alkoholov“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm. Prístup k 28. júnu 2021.