O hydratačné reakcie v alkadiéni oni sú adičné reakcie, to znamená, že zložky (hydrónium a hydroxid) molekuly vody sa pridajú k alkadiénu.
Vy alkadiéni sú uhľovodíky, ktoré majú medzi uhlíkmi otvorený reťazec a dve dvojité väzby (tvorené sigmou a pí), ako vidíme v nasledujúcej štruktúre:

Štruktúrny vzorec alkadiénu
pre hydratačná reakcia u alkadiénov je nevyhnutné, aby väzba pí prítomná v dvojitej väzbe bola prerušená pôsobením tepla a kyseliny sírovej (H2IBA4). Po rozbití väzby pí sa objavia dve väzobné miesta, každé na jednom z uhlíkov zahrnutých v dvojitej väzbe.

Vznik väzbových miest s narušením väzby pí
Vzhľad väzobných miest na molekule alkadiénu je nevyhnutný pre ióny (H+ a oh-) z vody sa pridávajú do alkadiénu za vzniku napríklad dialkoholu (alkoholu s dvoma hydroxylovými skupinami).
Doplnenie H+ a oh- v štruktúre alkadiénu
POZNÁMKA: Pridanie H+ a oh- v štruktúre alkadiénu nasleduje Vláda Markovnikova, tj+ sa viaže na najviac hydrogenovaný uhlík a OH- sa viaže na menej hydrogenovaný uhlík.

Príklad uplatnenia pravidla Markovnikov pri hydratácii alkadiénov
Pretože existujú rôzne typy alkadiénov, pokiaľ ide o polohu dvojitých väzieb, je možné, že hydratáciou alkadiénu vznikajú rôzne zlúčeniny. Pozrite sa na nasledujúce prípady:
→ Nahromadený alebo kondenzovaný alkadién
Je to alkadién, ktorý má dve dvojité väzby súčasne zahŕňajúce tri atómy uhlíka uhlík, to znamená, že neexistuje žiadna jednoduchá väzba oddeľujúca uhlíky obsiahnuté vo väzbách štvorhra.

Štruktúrny vzorec nahromadeného alkadiénu
Počas hydratačnej reakcie striedavého alkadiénu sú väzby pí prerušené, čo je H+ k viac hydrogenovaným uhlíkom a k OH- pridané k menej hydrogenovaným uhlíkom:
Rovnica akumulácie akumulácie alkadiénu
Máme za to, že pri hydratácii nahromadeného alkadiénu prijíma rovnaký atóm uhlíka dva hydroxylové skupiny a vytvára dvojitý alkohol, ktorý je nestabilnou štruktúrou.

Štruktúra dvojitého alkoholu
Pretože dvojitý alkohol je nestabilný, dochádza k tvorbe molekuly vody so zložkami týchto dvoch hydroxylových skupín a k vytvoreniu väzby pí medzi uhlíkom a kyslíkom.
Teraz neprestávajte... Po reklame je toho viac;)

Tvorba ketónu z dvojitého alkoholu
Preto bude mať hydratačná reakcia nahromadených alkadiénov za následok tvorbu a ketón.
→ Konjugovaný alebo alternatívny alkadién
Je to alkadién, ktorý má dve dvojité väzby súčasne zahŕňajúce štyri atómy uhlíka, to znamená, že existuje jednoduchá väzba oddeľujúca uhlíky obsiahnuté vo väzbách štvorhra.
Štruktúrny vzorec striedavého alkadiénu
U striedavých alkadiénov dochádza k rezonancii ich dvojitých väzieb. Elektróny väzby pí teda menia pozíciu (červené šípky), ako na nasledujúcom diagrame:
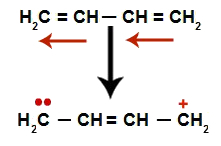
Schéma zobrazujúca rezonanciu v striedavom alkadiéne
Všeobecne máme vzhľad dvojitej väzby presne medzi uhlíkmi, kde boli predtým tieto dve štvorhry a vytvorenie dvoch väzbových miest, jedného na každom uhlíku, ktorý už nevytvára dvojitú väzbu (v príklade uhlíky 1 a 4). Uhlíky 1 a 4 reťazca dostanú H+ a oh- z vody.

Čiastočná hydratácia v striedavom alkadiéne
Po rezonancii sa väzba pí novej dvojitej väzby preruší a H+ a oh- sa k molekule alkadiénu pridajú. OH sa pridáva k uhlíku najbližšie k prvej pridanej OH skupine, pretože podlieha elektronickej príťažlivosti skupiny, ktorá je elektronegatívnejšia.

Ukončenie hydratácie v striedavom alkadiéne
Kvôli rezonancii hovoríme, že striedavý alkadién prešiel hydratáciou 1,4, čím vznikol dialkohol.
→ Alkadién izolovaný
Je to alkadién, ktorý má dve dvojité väzby zahŕňajúce najmenej päť atómov súčasne. uhlíka, to znamená, že existujú najmenej dve jednoduché väzby oddeľujúce uhlíky obsiahnuté vo väzbách. štvorhra.

Štruktúrny vzorec izolovaného alkadiénu
Počas hydratačnej reakcie izolovaného alkadiénu sa porušia väzby pí, H+ k viac hydrogenovaným uhlíkom a k OH- k menej hydrogenovaným uhlíkom.

Rovnica izolovanej hydratácie alkadiénu
Preto okrem prídavku izolovaného alkadiénu dochádza iba k tvorbe diaalkoholu.
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Hydratačné reakcie u alkadiénov“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/reacoes-hidratacao-alcadienos.htm. Prístup k 28. júnu 2021.