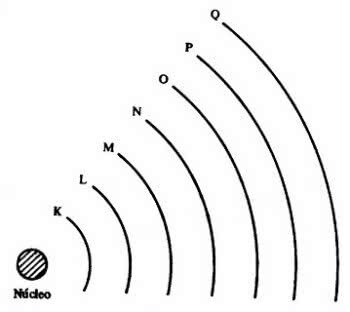
Diagram Paulinga, znany również jako Diagram Energii, to reprezentacja dystrybucji elektronicznej poprzez podpoziomy mocy.
Za pomocą tego schematu chemik Linus Carl Pauling (1901-1994) zasugerował coś wykraczającego poza to, co było już znane na temat rozkładu elektronów z atomów pierwiastków chemicznych.
Aby poprawić nastrój, Pauling zaproponował podpoziomy energetyczne. Dzięki nim możliwe byłoby ułożenie elektronów od najniższego do najwyższego poziomu energetycznego atomu w stanie podstawowym.
Dystrybucja elektroniczna Linusa Paulinga
Zgodnie z modelem zaproponowanym przez Paulinga elektrosfera dzieli się na 7 warstwy elektroniczne (K, L, M, N, O, P i Q) wokół jądra atomowego, z których każdy dopuszcza maksymalną liczbę elektronów, która wynosi odpowiednio 2, 8, 18, 32, 32,18 i 8 .
W dystrybucja elektroniki podpoziomy energetyczne, pokazując najpierw elektron o najniższej energii, aż do osiągnięcia elektronu o najwyższej energii.
| Warstwy elektroniczne | Maksymalna liczba elektronów | Podpoziomy energetyczne | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 i- | 1s2 | |||
| 2 | L | 8 i- | 2s2 | 2p6 | ||
| 3 | M | 18 i- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 i- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 i- | 5s2 | 5p6 | 5d10 | 5f14 |
| 6 | P | 18 i- | 6s2 | 6p6 | 6d10 | |
| 7 | Q | 8 i- | 7s2 | 7p6 |
Warstwa K ma tylko jeden podpoziom(y), warstwa L ma dwa podpoziomy (s i p), warstwa m ma trzy podpoziomy (s, p i d) i tak dalej.
Podpoziomy s pozwalają na do 2 elektronów, podczas gdy podpoziomy p pozwalają na do 6 elektronów. Następnie podpoziomy d pozwalają na do 10 elektronów, a podpoziomy f do 14 elektronów.
Zauważ, że suma elektronów zachowanych w każdym podpoziomie na powłokę elektronową daje maksymalną liczbę elektronów w każdej z 7 powłok.
K: s2 = 2
L i P: s2 + p6 = 8
M i P: s2 + p6 + d10 = 18
N i O: tak2 + p6 + d10 + f14= 32
To wtedy Pauling odkrył rosnący rząd energii:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Stamtąd na schemacie pojawiają się ukośne strzałki, aby dokonać elektronicznego rozmieszczenia elementów:
 Schemat Paulinga
Schemat Paulinga
Przykład dystrybucji fosforu elektronicznego 15P:
1s2 2s2 2p6 3s2 3p3
jak do 3s2 mieliśmy już w sumie 12 elektronów (2 + 2 + 6 + 2), potrzebujemy tylko 3 elektrony więcej z podpoziomu 3p6.
W ten sposób możemy uzyskać wymaganą ilość elektronów, o ile nie jest ona większa niż 6, co jest maksymalną liczbą, jaką podpoziom 3p6 zachowuje się.
Przeczytaj też Warstwa Walencji i Liczby kwantowe.
Rozwiązane ćwiczenia z dystrybucji elektronicznej
Pytanie 1
(Unirio) „Implanty dentystyczne są bezpieczniejsze w Brazylii i już spełniają międzynarodowe standardy jakości. Ogromny skok jakościowy nastąpił w procesie wytwarzania tytanowych śrub i szpilek, z których składają się protezy. Wykonane ze stopów tytanu protezy te służą do mocowania koron dentystycznych, aparatów ortodontycznych i protez w kościach szczęki i szczęki.” (Jornal do Brasil, październik 1996.)
Biorąc pod uwagę, że liczba atomowa tytanu wynosi 22, jego konfiguracja elektroniczna będzie wyglądać następująco:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Prawidłowa alternatywa: d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Diagram Linusa Paulinga dla rozkładu elektronów w tytanie to:
pytanie 2
(ACAFE) Biorąc pod uwagę dowolny ogólny element M, który ma konfigurację elektroniczną 1s2 2s2 2p6 3s2 3p6 4s2 3d5można powiedzieć, że:
JA. jego liczba atomowa wynosi 25;
II. ma 7 elektronów w ostatniej powłoce;
III. ma 5 niesparowanych elektronów;
IV. należą do rodziny 7A.
Stwierdzenia są poprawne:
a) tylko I, II i III
b) tylko I i III
c) tylko II i IV
d) tylko I i IV
e) tylko II, III i IV
Prawidłowa alternatywa: b) tylko I i III.
JA. POPRAWNY Licząc liczbę elektronów w rozkładzie elektronicznym widzimy, że użyto 25 elektronów. Stąd liczba atomowa wynosi 25 i odpowiada pierwiastkowi chemicznemu manganu.
II. ŹLE. Ostatnia warstwa, czyli warstwa zewnętrzna, ma 2 elektrony, czyli 4s2.
III. POPRAWNY Niesparowane elektrony znajdują się na podpoziomie d, który zawiera do 10 elektronów, ale w rozkładzie elektronowym manganu do podpoziomu przypisano tylko 5 elektronów.
IV. ŹLE. Mangan znajduje się w rodzinie 7B iw IV okresie.
pytanie 3
(UFSC) Liczba elektronów na każdym podpoziomie atomu strontu (38Sr) w porządku rosnącym energii to:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Prawidłowa alternatywa: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
Diagram Linusa Paulinga dla rozkładu elektronów strontu to:
Sprawdź swoją wiedzę jeszcze bardziej! Rozwiąż również:
- Ćwiczenia z dystrybucji elektronicznej
- Ćwiczenia z układu okresowego pierwiastków