Rozkład elektronów lub konfiguracja elektronów sposób uporządkowania pierwiastków chemicznych, biorąc pod uwagę liczbę posiadanych elektronów i ich bliskość do jądra atomowego.
Elektroniczna dystrybucja warstwowa
Po pojawieniu się kilku modeli atomowych, model Bohra zasugerował zorganizowanie elektrosfery na orbitach.
Elektrony są zorganizowane i rozprowadzone w warstwach elektronowych, z których niektóre znajdują się bliżej jądra, a inne dalej.
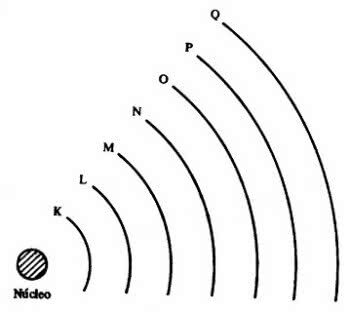
Potem pojawiło się 7 warstw elektronowych (K, L, M, N, O, P i Q), które są reprezentowane przez poziome linie o numerach od 1 do 7 w układzie okresowym.
Elementy na tych samych liniach mają taką samą maksymalną liczbę elektronów, a także te same poziomy energii.
W ten sposób można zaobserwować, że elektrony znajdują się na poziomach energetycznych i podpoziomach. Więc każdy ma pewną ilość energii.
|
Poziom energii |
Warstwa elektroniczna |
Maksymalna liczba elektronów |
|---|---|---|
| 1° | K | 2 |
| 2° | L | 8 |
| 3° | M | 18 |
| 4° | N | 32 |
| 5° | O | 32 |
| 6° | P | 18 |
| 7° | Q | 8 |
TEN warstwa walencyjna
jest to ostatnia warstwa elektronowa, czyli najbardziej zewnętrzna warstwa atomu. Według Reguła oktetu, atomy mają tendencję do stabilizowania się i stawania się neutralnymi.Dzieje się tak, gdy mają taką samą ilość protonów i neutronów, z ośmioma elektronami w ostatniej powłoce elektronowej.
Później pojawiły się podpoziomy energii, reprezentowane przez małe litery s, p, d, f. Każdy podpoziom obsługuje maksymalną liczbę elektronów:
| podpoziomy | Maksymalna liczba elektronów |
|---|---|
| s | 2 |
| P | 6 |
| re | 10 |
| fa | 14 |
Schemat Paulinga
Amerykański chemik Linus Carl Pauling (1901-1994) badał struktury atomowe i opracował schemat, który jest używany do dziś.
Pauling znalazł sposób na ułożenie wszystkich podpoziomów energii w porządku rosnącym, używając kierunku ukośnego. Schemat stał się znany jako Schemat Paulinga.
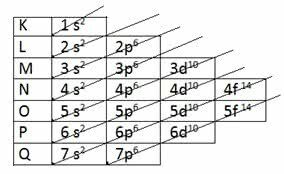
Rosnąco: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Zauważ, że liczba wskazana przed podpoziomem energii odpowiada poziomowi energii.
Na przykład w 1s2:
- s wskazuje podpoziom energii
- 1 wskazuje pierwszy poziom, znajdujący się na warstwie K
- wykładnik 2 wskazuje liczbę elektronów na tym podpoziomie
Jak prowadzić dystrybucję elektroniczną?
Aby lepiej zrozumieć proces dystrybucji elektronicznej, spójrz na rozwiązane ćwiczenie poniżej.
1. Wykonaj rozkład elektroniczny pierwiastka Żelazo (Fe), który ma liczbę atomową 26 (Z = 26):
Stosując diagram Linusa Paulinga, przekątne są przecinane w kierunku wskazanym w modelu. Podpoziomy energii są wypełnione maksymalną liczbą elektronów na powłokę elektronową, aż do ukończenia 26 elektronów elementu.
Aby dokonać rozkładu, zwróć uwagę na całkowitą liczbę elektronów na każdym podpoziomie i w odpowiednich warstwach elektronowych:
K - s2
L - 2s2 2p6
M - 3s2 3p6 3d10
N - 4s2
Zwróć uwagę, że nie było konieczne dokonywanie dystrybucji elektronicznej we wszystkich warstwach, ponieważ liczba atomowa żelaza wynosi 26.
Zatem elektroniczna dystrybucja tego elementu jest reprezentowana w następujący sposób: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Suma liczb wykładników wynosi 26, czyli całkowita liczba elektronów obecnych w atomie żelaza.
Jeżeli rozkład elektroniczny jest oznaczony warstwami, przedstawia się to następująco: K = 2; L = 8; M = 14; N = 2.
Skorzystaj z okazji, aby sprawdzić swoją wiedzę w Ćwiczenia z dystrybucji elektronicznej.
W układ okresowy pierwiastków, jest to pokazane w następujący sposób:

Przeczytaj też:
- Powinowactwo elektroniczne
- Liczby kwantowe
- Ćwiczenia z układu okresowego pierwiastków
- Ćwiczenia z organizacji układu okresowego pierwiastków