Batteri er en enhet der en elektrisk strøm produseres fra kjemisk energi som kommer fra a oksidasjonsreaksjon, det vil si at en art av reaktanten mister elektroner (oksidasjon), mens en annen art får elektroner (reduksjon).
Se representasjoner av oksidasjons- og reduksjonsreaksjonene som oppstår i en hvilken som helst stabel:
Oksidasjon: X → og + X+
Arter X mister et elektron og blir til et kation.
Reduksjon: Y- + og → Y
Y-anionet- får elektron og forvandles til en nøytral Y-art.
Grunnleggende komponenter i en stabel
De grunnleggende komponentene i en stabel er:
Anode: negativ elektrode der oksidasjonsreaksjonen foregår, det vil si tap av elektroner;
Katode: positiv elektrode der reduksjonsreaksjonen finner sted, det vil si elektronforsterkning;
Elektrolytisk løsning (saltbro) eller et ledende materiale (for eksempel en grafittstang): er måten elektroner gitt av anoden når katoden.
Grunnleggende om hvordan et batteri fungerer
Funksjonen til en stabel skjer fra følgende hendelser:
1. prinsipp: Anodeoksidasjon
Metallet i anoden, da det har en større tendens til å miste elektroner, blir et kation, slik vi observerte i ligningen nedenfor:
Zn → Zn2+ + 2 og
2. prinsipp: katodereduksjon
Kationene som er en del av materialet som er tilstede i katoden (vi vil bruke kobber som et eksempel), når de mottas elektronene fra anoden forvandles til metallisk kobber, som vi kan se i ligningen nedenfor:
Ass2+ + 2e → Cu
første hauger
a) Alessandro Voltas batteri
Alessandros bunke (den første bunken i historien), samlet i 1800, ble dannet av interkalerte metallskiver, som på bildet nedenfor:

Montering som Alessandros Back to your pile
Platene ble sammenflettet fordi de hadde forskjellig sammensetning. Den ene var laget av sinkmetall, og den andre var laget av kobber, og ble alltid skilt av bomull fuktet i saltlake (en løsning dannet av vann og salt).
Ikke stopp nå... Det er mer etter annonseringen;)
B) Daniels bunke
Daniels haug, samlet i 1836, besto av to halvceller forbundet med en ledende ledning og en saltbro.
Halvcelle 1: det var anoden, det vil si den negative polen på batteriet.
Den var sammensatt av en sinkplate, og en del av denne platen ble nedsenket i en løsning dannet av vann og sinksulfat (ZnSO4).
Halvcelle 2: det var katoden, det vil si batteriets positive pol.
Den var sammensatt av en kobberplate, og en del av denne platen ble senket i en løsning dannet av vann og kobbersulfat (CuSO4).
saltbro
U-formet rør som inneholdt en løsning dannet av vann og kaliumklorid (KCl), som forbinder de to halvcellene (sink og kobber) og hadde en glassull i begge ender.
batterier for øyeblikket
For tiden er det flere modeller av stabler, men generelt ser de slik ut:
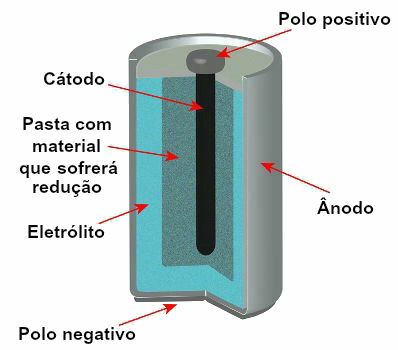
Skjematisk fremstilling av modellen til en nåværende stabel
De mest brukte modellene er det såkalte Leclanché-batteriet og det alkaliske batteriet, som har følgende forskjeller:
De) Leclanche haug
Den har en anode dannet av metallisk sink;
Den har en katode dannet av en pasta med ammoniumklorid, vann, stivelse og mangandioksid;
Den har en grafittstang som fungerer som en leder for elektronene som går fra katoden mot anoden.
B) Alkalisk batteri
Den har en anode dannet av metallisk sink eller kadmium;
Den har en katode dannet av kvikksølvoksid, nikkeloksid og jod;
Den må ha en blandet base i materialet som utgjør katoden.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er et batteri?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm. Tilgang 27. juni 2021.