Isomerisme det er et naturlig fenomen der forskjellige stoffer (når det gjelder kjemiske og fysiske egenskaper) har nøyaktig samme molekylformel, som i følgende eksempel:
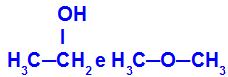
Ulike stoffer som har samme molekylformel
Etanol (til venstre) har molekylformelen C2H6O, som også forekommer med metoksyetan (til høyre), så de er isomerer.
Typer av isomerisme
→ flat isomer
Det er typen isomerisme som studerer de strukturelle forskjellene mellom isomerer.
De) Yrke
Det er typen flat isomerisme der forskjellen mellom stoffer er basert på forskjellen mellom de organiske funksjonene de tilhører. Se noen eksempler:
Propanon og propan:
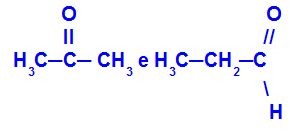
Isomerer som tilhører forskjellige funksjoner
Propanon (til venstre) tilhører ketongruppen, og propanal (til høyre) tilhører aldehydgruppen.
B) Fengsel
Det er typen flat isomerisme der forskjellen mellom stoffer er basert på forskjellen mellom kjedene de presenterer. Se et eksempel:
2-metyl-propan og butan
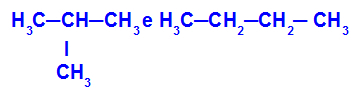
Isomerer som har kjeder med forskjellige klassifiseringer
I eksemplet kan vi se at 2-metyl-propan (til venstre) har en forgrenet kjede, og butan (til høyre) har en normal kjede.
ç) Posisjon
Det er typen flat isomerisme der forskjellen mellom stoffer er basert på forskjellen i posisjon til en komponent som er tilstede i kjedene deres. Se et eksempel:
1-klorpropan og 2-klorpropan
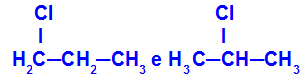
Isomerer som har komponenter på forskjellige posisjoner i kjeden
I eksemplet kan vi se at 1-klorpropan (til venstre) har klor plassert på karbon 1, og 2-klorpropan (til høyre) har klor plassert på karbon 2.
d) Metameria eller kompensasjon
MERK: Isomer er utelukkende gyldig for heterogene strenger.
Det er typen flat isomerisme der forskjellen mellom stoffene er basert på forskjellen i posisjonen til et heteroatom som er tilstede i deres kjeder. Se et eksempel:
Eksempel: Metoksypropan og etoksyetan
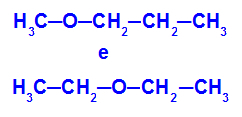
Isomerer som har heteroatomer i forskjellige posisjoner i kjeden
I eksemplet kan vi se at oksygen i metoksypropan (til venstre) har en radikal med ett karbon på den ene siden og tre karbonatomer på den andre. I etoksyetan (til høyre) har oksygen en radikal med to karbonatomer på den ene siden og to karbonatomer på den andre.
og)Kjøretøy
Det er et spesielt tilfelle av plane funksjonsisomerisme og forekommer i bare tre organiske funksjoner:
Aldehyde
keton
Enol
Denne typen isomerisme fungerer på det faktum at det er en kjemisk balanse mellom en enol og et aldehyd og mellom en enol og et keton, det vil si at disse komponentene konstant omdannes til hverandre. Se et eksempel:
Prop-2-en-1-ol og propanon
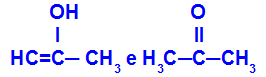
Isomerer som tilhører forskjellige funksjoner
I eksemplet kan vi se at Prop-2-en-1-ol (til venstre) tilhører gruppen enoler, og propanon (til høyre) tilhører gruppen ketoner, så de er isomerer av tautomery.
→ Romisomerisme
Det er en type isomerisme definert av romlig analyse av molekylet.
a) Geometriske isomerer
Ikke stopp nå... Det er mer etter annonseringen;)
Det er en type romlig isomerisme som oppstår når stoffet har molekyler med følgende egenskaper:
Lukket kjede som har to karbonatomer med to forskjellige ligander, som i eksemplet nedenfor:

Lukket struktur med geometrisk isomerisme
Åpen kjede som har en dobbeltbinding mellom karbonene, og i hvert av disse karbonene i dobbeltbindingen er det to forskjellige ligander, som i eksemplet nedenfor:
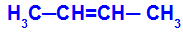
Åpen struktur med geometrisk isomerisme
Geometrisk isomerisme er delt inn i to grupper:
1O Gruppe: cis-trans
Det oppstår når de to ligandene av det ene karbonet er strengt lik de to ligandene av det andre karbonet, enten det er i den åpne strukturen eller i den lukkede strukturen.
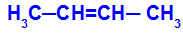
Kjede av et stoff som har cis-trans isomerisme
Isomeren vil bli kalt cis når de samme ligandene er i samme plan.

Eksempel på en cis-isomer
Isomeren vil bli kalt trans når de forskjellige ligandene er i samme plan.

Eksempel på en trans-isomer
2O Gruppe: E-Z
Det oppstår når de to ligandene av det ene karbonet er forskjellige i forhold til de to ligandene av det andre karbonet, enten i den åpne strukturen eller i den lukkede strukturen.

Kjede av et stoff som har E-Z-isomerisme
Isomeren vil bli kalt E når ligandene med høyest atomnummer er i motsatte plan. I eksemplet nedenfor har karbonet til venstre Br med høyest atomnummer (35), og i det andre er det oksygen (8).
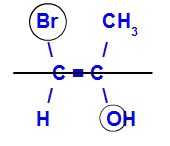
Eksempel på en E-isomer
Isomeren vil bli kalt Z når ligandene med høyest atomnummer er i samme plan. I eksemplet nedenfor har karbonet til venstre Br med høyest atomnummer (35), og i det andre er det oksygen (8).

Eksempel på en Z-isomer
B) optisk isomer
Det er en type romlig isomerisme som bare oppstår hvis stoffet har molekyler med kiralt karbon (den som har fire forskjellige ligander) i strukturene. Molekylet med kiralt karbon har evnen til å polarisere og avbøye lys, som følger:
Til høyre (høyre isomer)
Til venstre (levorotatorisk isomer)
En forbindelse med optisk aktivitet har alltid gjort aktive isomerer (kalt optiske antipoder) og inaktive isomerer (blanding mellom to aktive isomerer, en blanding kalt racemisk).
Vi kan bruke følgende formel for å bestemme antall aktive (IOA) og inaktive (IOI) isomerer av en forbindelse som har chiralt karbon:
IOA = 2Nei
IOI = 2Nei
2
Nedenfor er et eksempel på en forbindelse som har geometrisk isomerisme:
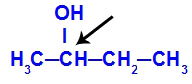
Kiralt karbon omtalt i butan-2-ol
Strukturen til butan-2-ol har følgende ligander:
Metyl (CH3)
Etyl (CH3-CH2)
Hydrogen (H)
Hydroksyl (OH)
Fordi det bare har ett chiralt karbon, har butan-2-ol derfor:
Aktive isomerer:
IOA = 21
IOA = 2
Inaktive isomerer:
IOI = 21
2
IOI = 2
2
IOI = 1
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er isomerisme?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Tilgang 27. juni 2021.