O benzen er en organisk forbindelse klassifisert som en aromatisk hydrokarbon. Det er mye brukt som råvare i næringer, i laboratorieprosesser, i stålbedrifter og i petrokjemisk industri for oljeraffinering.
Les også: Metan - den minste og enkleste av hydrokarboner
Formel
Benzen er en forbindelse med molekylformel Ç6H6og hvem har en ekstremt stabil strukturl. Strukturformelen for benzen er representert som følger:
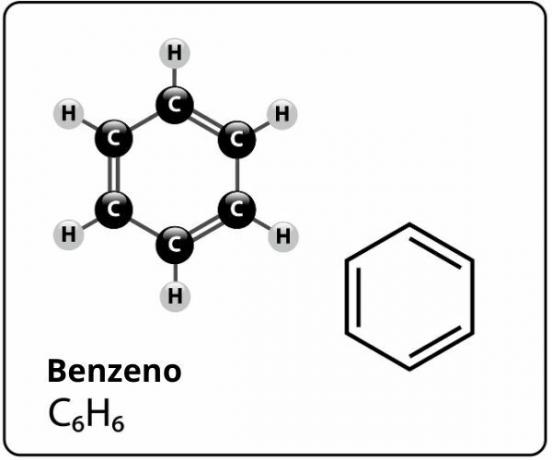
Hvem foreslo denne strukturen for benzen med seks karbonatomer bundet sammen med alternerende dobbeltbindinger, danner en sekskant og har festet et atom av hver til dem hydrogen, det var den tyske kjemikeren Friedrich August Kekule, i 1866.
Benzen gjennomgår et fenomen som kalles resonans, der elektronene i båndene mellom karbonene er forskjellige i sin posisjon. Av denne grunn kan benzen representeres som følger:
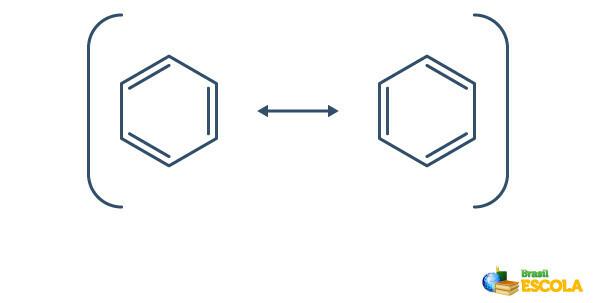
Den faktiske strukturen til benzen er et mellomledd mellom resonansstrukturene vist ovenfor. Dette betyr ikke at benzen noen ganger vises i en form, noen ganger den andre, og heller ikke at begge former eksisterer samtidig. Vi representerer benzen som følger:
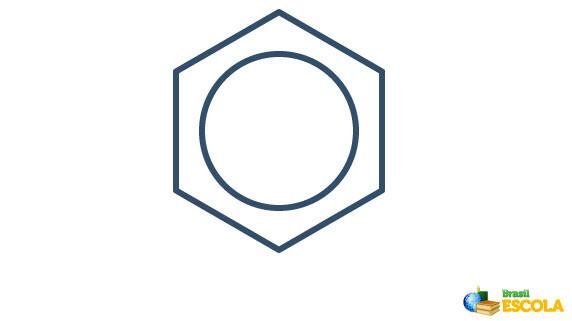
Sirkelen inne i sekskanten representerer resonansen mellom elektronene i bindingene.
Ikke stopp nå... Det er mer etter annonseringen;)
Funksjoner
- Benzen er en væske fargeløs, brannfarlig det er vanlig behagelig aroma karakteristisk.
- Molekylformel: C6H6.
- Molmasse: 78,11 g / mol.
- Tetthet: 0,876 g / cm³.
- Smeltepunkt: 5,5 ° C.
- Koketemperatur: 80,1 ºC - den lave koketemperaturen forklarer dens høye flyktighet (lett å fordampe).
Benzen er en giftig stoff og dampene kan forårsake svimmelhet, hodepine og besvimelse.
Les også:Karbonmonoksid - ekstremt giftig, fargeløs og luktfri gass
Anvendelser og toksisitet av benzen
benzen er hovedsakelig brukt som råvare i næringer for produksjon av andre stoffer, som plast og polymerer basert på styren, harpiks, lim, nylon, gummi, smøremidler, plantevernmidler, etc.
Benzen har blitt erstattet, hovedsakelig i laboratorier, av toluen, som har polaritet og løselighet ligner på benzen, men det er mindre giftig og med høyere koketemperatur.
Benzen er innenfor gruppen kjemiske stoffer som betraktes som kreftfremkallende, forårsaker skade på beinmarg og leukemi, når de utsettes for langvarig i høye konsentrasjoner. På kort sikt kan benzen forårsake svimmelhet, døsighet, rask hjerterytme, kramper og besvimelse.
Siden det er en flyktig væske, frigjør benzen gasser lett, og derfor forekommer benzenforurensning hovedsakelig gjennom luftveiene.
Hvor finnes benzen?
Det meste av benzen som slippes ut i miljøet resultater fra menneskelig handling, hovedsakelig i industriell virksomhet, men det kan også frigjøres som et biprodukt av branner og vulkanske aktiviteter.
benzen er en av bestanddelene i Petroleum og er tilstede i bensin, og slippes ut i atmosfæren ved å brenne bilbrensel. I tillegg finnes det også i brus og sigaretter.

Polaritet
Benzen er en ikke-polært molekyl, akkurat som alle andre Hydrokarboner og presenterer derfor veldig lav løselighet i vann (0,8 g / l ved 15 ° C). I noen laboratorieprosedyrer brukes benzen som et organisk løsningsmiddel for ikke-polare stoffer.
Nomenklatur
Det er en regel som bare brukes på nomenklaturen for aromatiske forbindelser, det vil si de som har benzen i strukturen. Denne regelen er delt inn i to tilfeller, som avhenger av mengden radikaler festet til benzenringen.
1. SAK: når det bare er en radikal festet til benzenringen, blir navnet gitt etter følgende regel:
RADIKALT NAVN + BENZEN
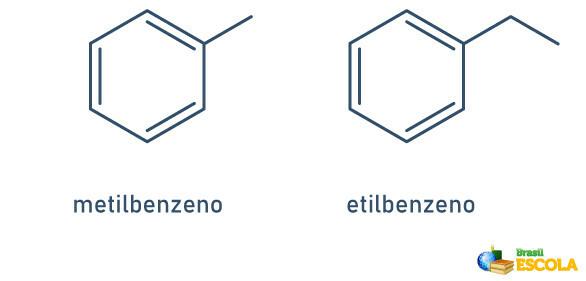
Merk at det ikke er nødvendig å indikere posisjonen til stilken.
2. SAK: når det er mer enn en radikal knyttet til benzen, følger navnet følgende regel:
RADIKAL POSISJON + RADIKALT NAVN + BENZENE
Se eksemplet:

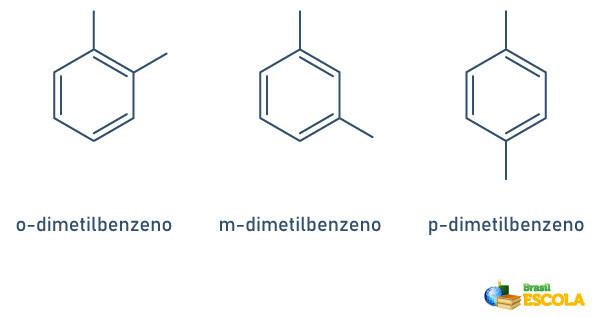
Når benzenringen bare har to tilknyttede radikaler, er det en spesifikk nomenklatur som kan brukes:
- 1,2 eller orto (o);
- 1.3 eller mål (m);
- 1.4 eller til (p).
Se eksemplene:
Les også: Ammoniumnitrat - meget reaktiv forbindelse brukt til fremstilling av eksplosiver
Nysgjerrigheter
- Benzen er et ekstremt kreftfremkallende stoff som blir klassifisert av International Agency av kreftforskning, i gruppe 1, sammen med tobakk, dieselrøyk og kjøtt Bearbeidet.
- Det er flere reguleringsorganer som begrenser eksponering og utslipp av benzen i forskjellige land. I Brasil er denne rollen Anvisas ansvar.
- Før du kjente risikoen, ble benzen brukt i kosmetikk, for eksempel etterbarbering, på grunn av den behagelige lukten.
Av Victor Ricardo Ferreira
Kjemilærer
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FERREIRA, Victor Ricardo. "Benzen"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/benzeno.htm. Tilgang 27. juni 2021.
Kjemi

Aromatiske forbindelser, arenaer, polaritet, uoppløselig, løselig, ikke-polare løsningsmidler, eter, karbontetraklorid, hydrokarboner, insektmidler, fargestoffer, løsningsmidler, eksplosiver, kreftfremkallende stoffer, toluen, metylbenzen, medisiner, lim skomaker.