Du basiske oksider de er de som, når de reagerer med vann, gir opphav til baser. Når de reagerer med en syre, danner de salt og vann.
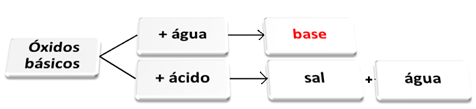
Basiske oksider som reagerer med vann og syre.
For eksempel har vi natriumoksid (Na2O), som er et basisk oksid. Se nedenfor at når det reagerer med vann, danner det natriumhydroksidbase:
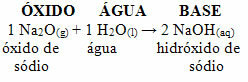
Hvis det samme oksidet reagerer med en syre som svovelsyre (H2KUN4), et salt (natriumsulfat) og vann vil bli produsert.
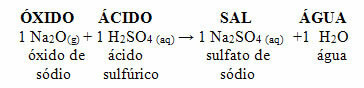
Hvis et basisk oksid reagerer med et surt oksid, dannes det også et salt, men uten vannet.
Som vist i eksemplet vist, er de andre basiske oksidene også ioniske forbindelser som dannes i deres for det meste av metaller, grunnstoffer som er svært elektropositive, som normalt presenterer en "ladning" lik +1 eller +2.
Eksempler:
På2O = Na1+
K2O = K1+
CaO = Ca2+
MgO = Mg2+
Disse forbindelsene har høye smelte- og kokepunkter og alle omslutter oksygenanionet (O2-).
Bruk av noen grunnleggende oksider:
• Hund: Kalsiumoksid
Denne forbindelsen er vanligvis kjent som brent kalk. Ved reaksjon med vann, i henhold til reaksjonen nedenfor, dannes en base (kalsiumhydroksid) som brukes til å male vegger, trestammer og andre materialer, med hovedformålet å avvise insekter, bevare forseglingen og forhindre infiltrasjon fra vann. Denne dannede basen kalles
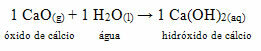

Kalkmaling.
• K2O: kaliumoksid
Kaliumoksid finnes ofte i tre og sigarettaske. Når det reagerer med vann, danner det basen kaliumhydroksid (KOH), som brukes til fremstilling av såper. Selv tidligere, på steder der det ikke var KOH, ble det brukt vegetabilsk aske, som inneholdt K2O, å reagere med fett og produsere den såkalte "gråsåpe".
Av Jennifer Fogaça
Uteksaminert i kjemi
Kilde: Brasil skole - https://brasilescola.uol.com.br/quimica/oxidos-basicos.htm
