DE titrering er en laboratorieprosedyre som brukes til å bestemme konsentrasjonen i mengde stoff (eller konsentrasjon i mol/L) av en løsning som inneholder en syre eller en base.
Under titreringen er det alltid en blanding av løsninger som inneholder forskjellige oppløste stoffer med forekomst av kjemisk reaksjon. Siden blandede løsninger alltid har en syre og en base, er den kjemiske reaksjonen som finner sted en nøytralisering.
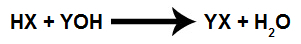
Kjemisk ligning som representerer en titrering.
Prosessen for å bestemme den molare konsentrasjonen av en ukjent løsning under titrering avhenger av følgende faktorer:
• Kjenne til den molare konsentrasjonen av løsningen som vil bli blandet med det ukjente;
• Kjenne til volumet av løsningen med ukjent konsentrasjon;
• Kjenn volumet av løsning med kjent konsentrasjon.
Formel brukt i en titrering
Og i titrering en nøytralisering skjer (likt antall mol syre og base), kan vi bruke følgende formel for å bestemme den molare konsentrasjonen av den ukjente løsningen:
NeiDe = nB
MDe.VDe = MB.VB
Merk: Antall mol er produktet mellom molkonsentrasjonen (M) og volumet av en løsning (V).
Utstyr som trengs for å utføre en grad
• Burette: utstyr som brukes til å måle volumet av løsning med kjent konsentrasjon;

• Erlenmeyer: utstyr som brukes til å motta løsningen med ukjent konsentrasjon;
• Universell støtte: utstyr som kloen er festet til;

• Klo: utstyr som brukes til å holde byretten;

• Magnetrører: utstyr som brukes til å røre løsningen som finnes i Erlenmeyer-kolben.

Trinn av en grad
-
1. trinn: fest byretten til den universelle støtten ved hjelp av kloen;
-
2. trinn: plasser Erlenmeyer-kolben på magnetrøreren;
-
3. trinn: tilsett et visst volum, inne i Erlenmeyer-kolben, av løsningen med ukjent konsentrasjon. For eksempel: tilsett 10 ml av løsningen til Erlenmeyer-kolben;
- 4. trinn: tilsett fenolftalein til løsningen i Erlenmeyer-kolben.
Merk: Hvis løsningen i Erlenmeyer-kolben er sur, når du tilsetter fenolftalein, vil forbli uendret i fargen, men hvis løsningen er basisk, vil den være rosa rødaktig.

Fenolftalein tilsatt til en grunnleggende karakteristisk løsning.
-
5. trinn: legg til en magnetstang inne i Erlenmeyer-kolben. Slå deretter på magnetrøreren slik at væsken inne i Erlenmeyeren blir rørt;
-
6. trinn: tilsett inne i byretten, opp til maksimal kapasitet, et volum av en løsning med kjent konsentrasjon, det vil si hvis byretten er 50 ml, tilsett 50 ml av denne løsningen.
- 7. trinn: åpne byrettventilen og la væsken fra dens indre falle ned i Erlenmeyer-kolben.
Observasjoner gjort under titreringen
Så snart byretten er åpnet på Erlenmeyer-kolben, begynner nøytraliseringsreaksjonen, det vil si at syren reagerer med basen, og danner gradvis salt og vann.
Når nøytraliseringsreaksjonen skjer med blandingen, vil fargen på løsningen som er tilstede i erlenmeyer endrer seg også gradvis, det vi kaller vendepunktet, som følger:
- Hvis det var fargeløst, begynner det å se ut rosarødaktig,
- hvis det var detrosarødaktig, begynner å bli fargeløs.
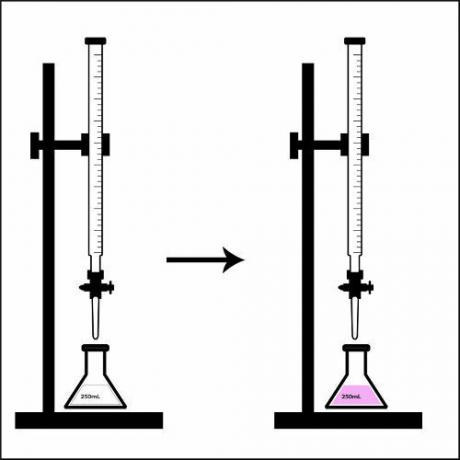
Representasjon av vendepunktet i en titrering.
Når løsningen som er tilstede i erlenmeyerkolben helt endrer farge, det vil si at den har nådd vendepunktet, sier vi at titreringen er over. I det øyeblikket er det bare å sjekke det brukte volumet av løsningen med kjent konsentrasjon som var der på byretten.
Fra summen mellom volumet av løsningen med kjent konsentrasjon, som ble bestemt i byretten, og volum av den ukjente løsningen, som var erlenmeyer-kolben, er vi i stand til å bestemme konsentrasjonen jeksel.
Av meg Diogo Lopes Dias
Kilde: Brasil skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-titulacao.htm