Smeltepunktet og kokepunktet representerer temperaturen der et stoff endrer tilstand ved et gitt trykk.
Når det gjelder smeltepunktet, endres stoffet fra fast tilstand til flytende tilstand. Kokepunktet refererer til endringen fra flytende tilstand til gassform.
For eksempel begynner is å bli vann i flytende form når temperaturen er lik 0 ° C. Derfor er smeltepunktet for vann 0 ° C (under et trykk på 1 atmosfære).
For å skifte fra væske til damp må vannet nå en temperatur på 100 ° C. Dermed er vannets kokepunkt 100 ° C (under et trykk på 1 atmosfære).

Fusjonspunkt
Når et stoff i fast tilstand mottar varme, er det en økning i graden av agitasjon av molekylene. Derfor øker temperaturen.
Når en viss temperatur (smeltepunkt) er nådd, er molekylenes uro slik at de bryter de indre bindingene mellom atomer og molekyler.
På dette tidspunktet begynner stoffet å endre sin tilstand og vil gå i flytende tilstand hvis det fortsetter å motta varme.
I løpet av Fusjon temperaturen forblir konstant, siden den mottatte varmen brukes utelukkende til tilstandsendring.

Varmen per masseenhet som kreves for å endre faser kalles latent varme av fusjon (Lf) og er et kjennetegn ved stoffet.
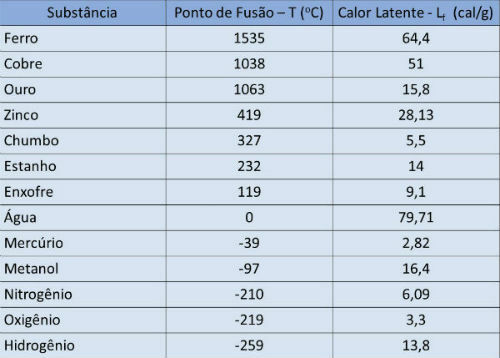
Smeltepunkt og latent varmebord
I tabellen nedenfor indikerer vi smeltepunktstemperaturen og den latente varmen til noen stoffer til atmosfærisk trykk.
Kokepunkt
DE kokende det er preget av rask passering fra en væske til en gassform, med dannelse av damp (bobler) inne i væsken.
Som i fusjon er det en temperatur (kokepunkt) der et gitt stoff skifter fra en væske til en gassform.
For at dette skal skje, må stoffet motta varme. Under hele faseendringen forblir temperaturen konstant.
den latente varmen av fordampning (Lv) er mengden varme per masseenhet som kreves for at et stoff skal skifte fase.
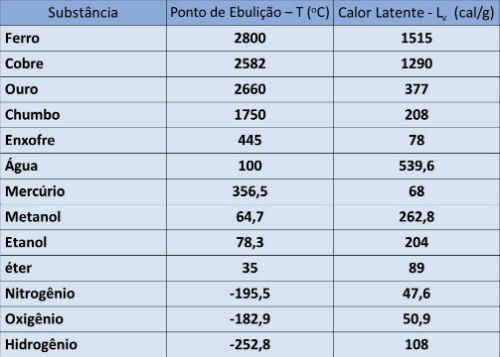
Kokepunkt og latent varmebord
I tabellen nedenfor indikerer vi kokepunktstemperaturen og den latente fordampningsvarmen til noen stoffer ved atmosfæretrykk.
Trykkinterferens
Temperaturen på smeltepunktet og kokepunktet avhenger av trykket som utøves på stoffet.
Generelt øker stoffene i volum når de gjennomgår fusjon. Dette faktum betyr at jo høyere trykket er, desto høyere temperatur for stoffet å endre sin fase.
Unntaket forekommer med noen stoffer, inkludert vann, som reduserer volumet når det smeltes. I dette tilfellet vil høyere trykk senke smeltepunktet.

En reduksjon i trykket fører til at kokepunktet til et gitt stoff er lavere, noe som betyr at stoffet vil koke ved en lavere temperatur.
For eksempel koker vann på steder over havnivå ved temperaturer under 100 ° C. Som et resultat tar det mye lengre tid å lage mat på disse stedene enn steder på havnivå.
Les også:
- Endringer i fysisk tilstand
- Termometriske skalaer
- Termometriske skalaer - Øvelser
- Fysiske tilstander av vann
- Fasediagram
- Størking
- Kondensasjon
- Colligative egenskaper
- Periodiske egenskaper
- Fordampning
- Øvelser på det periodiske systemet



