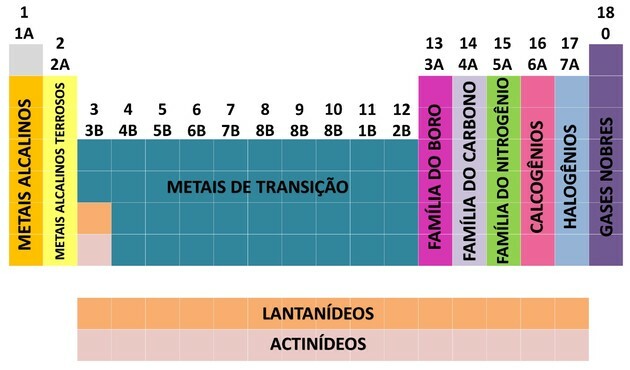
En av måtene kjemiske elementer er organisert på er gjennom familier, som tilsvarer de vertikale sekvensene i det periodiske systemet.
På 18 kolonner av tabellen grupperer elementene etter likheter i kjemiske egenskaper.
Å organisere de kjemiske elementene i familier var en praktisk måte å strukturere den forskjellige informasjonen som ble funnet og presentere dem på en enkel måte.
For å lette plasseringen av et kjemisk element ble familiene utpekt i antall fra 1 til 18 som vist nedenfor:
Gjennom bidrag fra mange forskere og forskjellige forsøk på å ordne dataene, utviklet det periodiske systemet seg, og etablerte en ordre for å ordne elementene.
Nomenklatur for familier
- Familiene i tabellen ble delt inn i A (representativ) og B (overgang), identifisert med bokstaver og tall.
- Du representative elementer familiene 0, 1A, 2A, 3A, 4A, 5A, 6A og 7A tilsvarer.
- Du overgangselementer familiene 1B, 2B, 3B, 4B, 5B, 6B, 7B og 8B tilsvarer.
- Ved bestemmelse av International Union of Pure and Applied Chemistry (IUPAC) ble familiene identifisert i grupper fra 1 til 18.
Periodisk system og elektronisk distribusjon
Likhetene mellom elementene i den samme familien oppstår fordi antall valenselektroner til atomet i jordtilstanden er det samme for medlemmene i en bestemt gruppe.
For eksempel:
| Gruppe 1 | Elektronisk distribusjon |
|---|---|
| 3lese | 2-1 |
| 11På | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Gruppe 1-atomer har elektronene fordelt over mer enn ett energinivå, men alle har et valenselektron.
Med det observerer vi at det å lage elektronisk distribusjon av atomet i grunntilstanden, finner vi dets posisjon på det periodiske systemet.
representative elementer
Representative elementer utviser relativt mindre kompleks kjemisk oppførsel enn overgangselementer og danner de fleste av stoffene rundt oss.
Noen av de representative elementfamiliene får spesielle navn, som vist nedenfor:
Gruppe |
Familie | spesifikt navn | Navn opprinnelse | Elementer | elektronisk konfigurasjon |
|---|---|---|---|---|---|
| 1 | 1A | alkaliske metaller | fra latin alkali, som betyr "grått av planter". | Li, Na, K, Rb, Cs og Fr | oss1 |
| 2 | 2A | jordalkalimetaller | Uttrykket "jordisk" refererer til "eksisterende på jorden". | Vær, Mg, Ca, Sr, Ba og Ra | oss2 |
| 13 | 3A | borefamilien | Navnet på det første elementet i familien. | B, Al, Ga, In, Tl og Nh. | oss2np1 |
| 14 | 4A | karbonfamilie | Navnet på det første elementet i familien. | C, Si, Ge, Sn, Pb og Fl. | oss2np2 |
| 15 | 5A | Nitrogenfamilien | Navnet på det første elementet i familien. | N, P, As, Sb, Bi og Mc. | oss2np3 |
| 16 | 6A | Kalkogener | fra gresk khalks, da de er elementer som finnes i kobbermalm. | O, S, Se, Te, Po og Lv. | oss2np4 |
| 17 | 7A | Halogener | Gresk uttrykk som betyr saltdannere. | F, Cl, Br, I, At og Ts. | oss2np5 |
| 18 | 0 | Edle gasser | Det ble vurdert å ikke reagere med andre stoffer. | Han, Ne, Ar, Kr, Xe, Re og Og. | 1s2 (Han) eller oss2np6 |
Gjennom tabellen kan vi se at:
- Elementene presentert ovenfor er klassifisert som representative fordi de har det mest energiske elektronet i et s- eller p-undernivå.
- Elektroner fordeles over energinivåer og n representerer det ytterste nivået av atomet i grunntilstanden.
- De representative elementene, i henhold til IUPACs anbefaling, tilhører gruppene eller familiene 1,2,13,14,15,16,17 og 18.
O hydrogen er klassifisert bortsett fra de andre elementene. Selv med 1s elektronisk konfigurasjon1, han er ikke en del av gruppe 1 fordi han har en enestående oppførsel.
overgangselementer
Overgangselementene tilsvarer gruppe 3 til 12. De får dette navnet fordi de har mellomegenskaper mellom gruppe 1 og 2 og de representative ikke-metalliske elementene.
Du overgangsmetaller er definert av IUPAC som:
Et overgangselement har et ufullstendig d-undernivå eller kan danne kationer med et ufullstendig d-undernivå.
Når det mest energiske elektronet til grunntilstandsatomet befinner seg i et ufullstendig undernivå, karakteriseres det som en ytre overgang.
Lanthanider og aktinider er interne overgangselementer, da de har minst ett ufullstendig f undernivå.
Når elementer har elektroner som fyller d- eller f-orbitalene, har de lignende egenskaper og kan klassifiseres i d- eller f-orbitalelementer. ytre eller indre overgang.
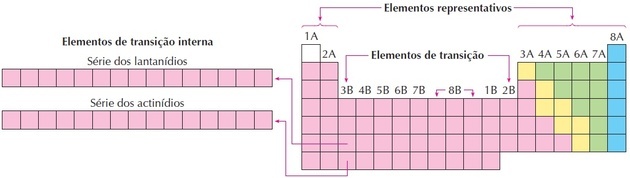
Som vi kan se på bildet, tilsvarer familie 8B 3 kolonner, de er gruppene 8, 9 og 10, som ble gruppert slik fordi de har lignende egenskaper.
Hovedtrekk ved familier
Tabellen nedenfor viser hovedegenskapene til gruppene i periodisk tabell:
| Gruppe | Funksjoner | sammensatte stoffer mer vanlig |
forekomster |
|---|---|---|---|
| 1 | Solid og skinnende i omgivelsesforhold. Veldig reaktive, myke og gode ledere av elektrisitet. | Salter, hydroksider og oksider |
Reager med halogener og dann salter. |
| 2 | Mindre reaktivt og vanskeligere enn gruppe 1. Sølvfaststoffer med god ledningsevne. | Salter, hydroksider og oksider |
Danner salter og oksider. |
| 3 til 12 | De danner komplekser. De er metalliske faste stoffer, harde og sprø, med unntak av kvikksølv, som er en væske. | Salter, oksider og komplekser. Eks: AgNO3, TiO og [Cr (OH)3(H2O)3] |
I mineraler i form av oksider. |
| 13 | Tørrstoffer i omgivelsesforhold, sølv, bortsett fra bor. | Oksider Eks: B2O3 |
I mineraler i form av oksider. |
| 14 | Fast i omgivelsesforhold. | Atomer av C og Si kan ordne seg i kjeder og produsere et stort utvalg av stoffer. | I levende organismer og i form av silikater eller oksider. |
| 15 | Tørrstoffer, unntatt nitrogen, som er gassformig under omgivelsesforhold. | Oksider og syrer Eks: NEI2 og H3STØV4 |
Atmosfære, levende organismer og mineraler. |
| 16 | Tørrstoffer, unntatt oksygen, som er gassformig under omgivelsesforhold. | Sulfider og oksider Eks: ZnS og SiO2 |
Atmosfære, levende organismer og mineraler. |
| 17 | De danner kiselgurmolekyler og er veldig reaktive. De er dårlige ledere av elektrisitet og varme. De er aggressive mot levende vesener og miljøet. | Syrer og salter. Eks: HCl og KBr |
Er til stede i stoffer organisk og mineralsk. |
| 18 | De er veldig stabile og finnes i form av gasser. | De danner knapt sammensatte stoffer. | Gasser i atmosfæren. |
Kjemiske og fysiske egenskaper skiller en familie fra en annen. Som vi har sett, er kjemiske egenskaper knyttet til elektroner av valens, og gjennom dem samhandler et atom med et annet, og er ansvarlig for kjemisk oppførsel og kjemiske bindinger dannet.
De fysiske egenskapene til grunnstoffer i samme gruppe kan variere i henhold til atomnummer og masse.
Øvelser
Nå som du vet litt mer om periodiske systemfamilier, kan du teste kunnskapen din og se hva du har lært.
1) Vurder følgende utdrag fra det periodiske systemet.
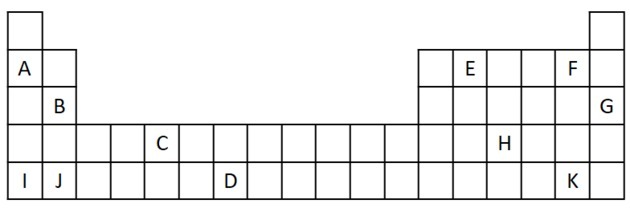
a) Nevn to elementer som har to valenselektroner.
b) Angi et element som reagerer voldsomt med vann og produserer et metallhydroksid.
c) Angi et ikke-reaktivt element.
d) Angi to grunnstoffer som kombineres med alkalimetaller for å danne salter.
Svare:
a) B og J
To valenselektroner tilsvarer gruppe 2, som har en ns-elektronkonfigurasjon2 og er representert i øvelsen av B og J.
b) A, B, I eller J.
A og jeg representerer elementer i familie 1; B og J er fra familie 2. Som vi så i egenskapstabellen, er gruppe 1 og 2-elementer veldig reaktive og kan danne hydroksider, som i eksemplene gitt: KOH og Mg (OH)2.
c) G
Edelgasser er veldig stabile og derfor ikke veldig reaktive. Bokstaven G er satt inn i tabellen som et element i denne familien.
d) F og K
Halogener reagerer med alkalimetaller for å danne salter. Det vanligste eksemplet på dette er bordsalt, NaCl.
2) Følgende figur viser tre kjemiske elementer, fra venstre til høyre, litium, natrium og kalium.

Velg alternativet som fullfører riktig hver av følgende utsagn.
1.1) "Vi kan si at litium, natrium og kalium ...
(A)… tilhører samme periode. ”
(B)... har samme atomnummer. ”
(C)… tilhører samme gruppe. ”
(D)... har samme massenummer. ”
1.2) "Elementene litium, natrium og kalium ...
(A)... har veldig like kjemiske egenskaper. ”
(B)... har veldig forskjellige kjemiske egenskaper. ”
(C)… er ikke-metaller. ”
(D)... reager med vann for å danne sure løsninger. ”
Svar:
1.1) (C) tilhører samme gruppe.
1.2) (A) har veldig like kjemiske egenskaper.
Vi kan få denne informasjonen ved å gå gjennom det periodiske systemet eller ved å foreta den elektroniske fordelingen av elementene litium, natrium og kalium. Vi vil se at de tre har et elektron i valensskallet, og fordi de er en del av samme gruppe, er de kjemiske egenskapene veldig like.
3) Tenk på følgende tabell, der atomnummer og elektroniske fordelinger av noen kjemiske elementer er representert.
| Element | kjemisk symbol | atomnummer | Elektronisk distribusjon |
|---|---|---|---|
| Litium | lese | 3 | 2,1 |
| Beryllium | være | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Hu h | 10 | 2,8 |
| klor | Cl | 17 | 2,8,7 |
| argon | Luft | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Kalsium | Her | 20 | 2,8,8,2 |
Angi gruppen for hvert element.
Svare:
Litium og kalium: gruppe 1. (De har et elektron i valensskallet).
Beryllium og kalsium: gruppe 2. (De har to elektroner i valensskallet).
Fluor og klor: gruppe 17. (De har syv elektroner i valensskallet).
Neon og argon: gruppe 18. (De har åtte elektroner i valensskallet).
Sjekk opptakseksamen med en kommentert oppløsning i Øvelser på det periodiske systemet og upubliserte spørsmål om emnet i Øvelser i å organisere det periodiske systemet.