Katalysatorer er stoffer som er i stand til å akselerere en reaksjon uten å bli endret, det vil si at de ikke forbrukes under reaksjonen.
For å forstå hvordan katalysatorer fungerer, må vi huske hva som ble forklart i teksten "Aktiveringsenergi”. Som vist der, for at en kjemisk reaksjon skal starte, er det nødvendig at reaktantene har eller mottar en viss mengde minimumsenergi, som kalles aktiveringsenergi.
Med denne minimale energien er reaktantene i stand til å nå kompleks aktivert, som er en mellomtilstand (overgangstilstand) som dannes mellom reaktanter og produkter, der strukturen eksisterer de svekkede tidligere koblingene og dannelsen av nye lenker (til stede i Produkter).
Tenk for eksempel på den generiske reaksjonen nedenfor:
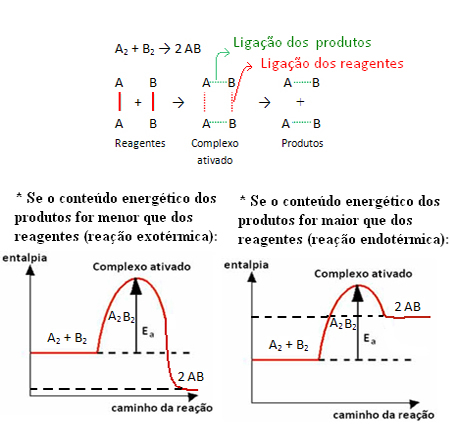
Merk at aktiveringsenergien som trengs for å nå det aktiverte komplekset, blir en slags hindring som må overvinnes for at reaksjonen skal finne sted. Dette betyr at jo større aktiveringsenergi til en reaksjon, jo større hindring skal overvinnes og jo lavere reaksjonshastighet.
Det motsatte er også sant, hvis aktiveringsenergien er lavere, vil reaksjonen bli raskere. Det er akkurat det katalysatorene gjør de de skaper en alternativ vei som krever mindre aktiveringsenergi, noe som gjør at reaksjonen går raskere.
Ikke stopp nå... Det er mer etter annonseringen;)

For å senke aktiveringsenergien, virker katalysatoren ved å endre reaksjonsmekanismen, ved å kombinere med reagensene i et system som kan være monofasisk (homogen katalyse) eller polyfasisk (heterogen katalyse).
Mer informasjon om disse typer katalyse kan sees i tekstene nedenfor:
- homogen katalyse
- heterogen katalyse
Men generelt sett kan vi si at dette kombinasjonen av reaktanten og katalysatoren danner en mellomforbindelse som deretter transformeres til produktet og katalysatoren. Legg merke til hvordan dette kan vises:
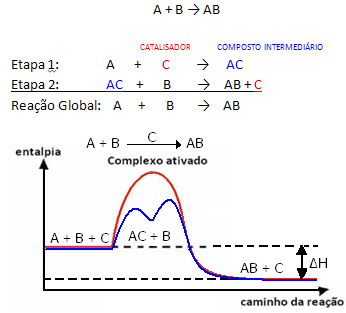
Se til at katalysatoren regenereres ved slutten av reaksjonen, og ikke forbrukes av den.
Et viktig faktum er at katalysatoren akselererer både reaksjonene forover og bakover, det betyr at det reduserer aktiveringsenergien til begge.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hvordan virker katalysatorstoffer?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Tilgang 27. juni 2021.