Handlingen til en katalysator er i utgangspunktet å akselerere utviklingen av en viss reaksjon. Dette er mulig fordi katalysatoren endrer mekanismen hvormed reaksjonen fortsetter, og fører til en "alternativ vei" som krever mindre aktiveringsenergi for at reaksjonen skal starte og nå det aktiverte komplekset.
Det er flere typer katalyse, hvorav den ene er heterogen katalyse, som kan defineres som det som oppstår når systemet har mer enn en fase, det vil si at reaktantene og produktene er i en fysisk tilstand som er forskjellig fra den fysiske tilstanden til katalysatoren.
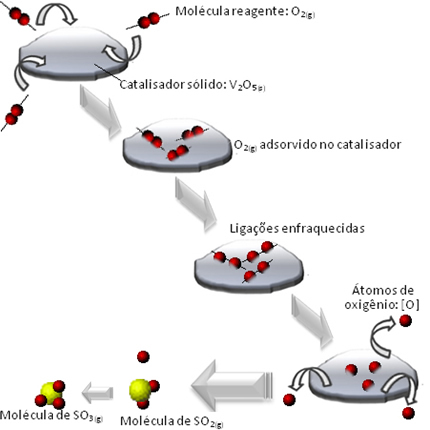
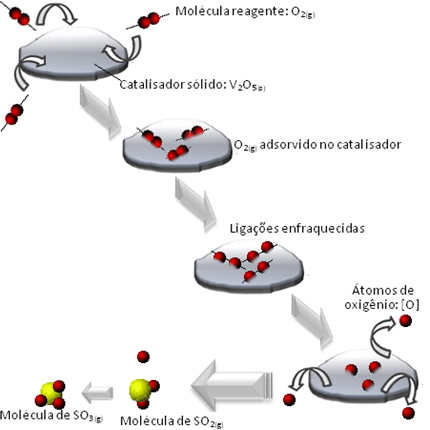
Et eksempel vi kan nevne er et mellomtrinn av svovelsyredannelse (H2KUN4 (aq)). Dette trinnet består av dannelsen av svoveltrioksid (SO3 (g)) gjennom forbrenningsreaksjonen av svoveldioksid (SO2 (g)):
2 SÅ2 (g) + O2 (g) → 2 OS3 (g)
Ettersom denne reaksjonen går så sakte, brukes en katalysator for å øke hastigheten. En katalysator som kan brukes i dette tilfellet er divanadiumpentoksid (V2O5 (S)), som er solid. Siden reaktantene og reaksjonsproduktet er gassformede, vil vi ha et heterogent system.
Men hvordan kan divanadiumpentoksid øke hastigheten på reaksjonen?
Det som skjer er at molekylene i oksygenreagenset adsorberes, det vil si beholdes på overflaten av divanadiumpentoksidet. Dette fører til at bindingene til molekylene i denne gassen svekkes over tid, noe som letter dannelsen av komplekset aktiveres, og reduserer følgelig reaksjonsaktiveringsenergien og øker dens utviklingshastighet, det vil si dens hastighet.
Ikke stopp nå... Det er mer etter annonseringen;)
Se hvordan dette skjer i diagrammet nedenfor:
Andre eksempler på heterogen katalyse er vist nedenfor. Merk at i begge tilfeller er reaktantene og produktene i gassformige, vandige eller flytende tilstander, mens katalysatorene er i fast tilstand:
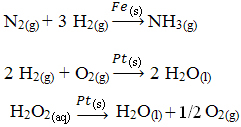
Et eksempel på heterogen katalyse som skjer i vårt daglige liv er omformere bil katalysator, bedre kjent som katalysatorer. Disse antiforurensningsinnretningene er belagt med stoffer som fungerer som katalysatorer vanligvis en legering av palladium og rodium (for bensinmotorer) og palladium og molybden (for bensinmotorer). alkohol).
Innen denne katalysatoren oppstår kjemiske reaksjoner der gasser fra ufullstendig forbrenning, som er mer skadelige for mennesker, omdannes til giftfri gasser. Reaktanter og produkter er alle gasser, mens katalysatorer er faste stoffer.
For å forstå mer om operativsystemet til dette utstyret, les teksten: "Katalysator”.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Heterogen katalyse"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm. Tilgang 27. juni 2021.