Ензими са биологични катализатори, отговорни за увеличаване на скоростта на дадена химична реакция. Ензимите обикновено са протеини, но има и такива рибонуклеинови киселини които действат като ензими, наричайки се рибозими.
За да ускорят реакцията, ензимите трябва да се свързват с реагентите, които са известни като субстрати. Дълго време се смяташе, че тази връзка се случва по много твърд начин, модел, известен като ключалка. в момента, Въпреки това, се приема моделът, известен като индуциран монтаж., което предполага, че се появяват леки промени под формата на ензима, когато субстратът навлезе в активното място.
Прочетете също: Какво представлява метаболизмът?
Какво представляват ензимите?
Ензимите са биомолекули, които действат като катализатори, тоест те са вещества, способни да ускорят скоростта на химична реакция които се срещат при живите същества, без да бъдат консумирани по време на тези реакции. Без действието на ензимите някои реакции биха били много бавни, което би навредило на метаболизма. Ензимите селективно ускоряват реакциите и следователно са много специфични катализатори.
Ензимите са способни да ускорят реакцията, като намаляват енергията на активиране, тоест намаляват количеството енергия, което трябва да се добави, за да започне реакцията.
[публикация_omnia]
Всеки ензим протеин ли е?
Въпреки че те често се определят като биологични катализатори с протеинова природа, не всеки ензим е протеин. Има някои РНК, които функционират като ензими, наречени рибозими. Повечето ензими обаче са протеини, които се образуват, следователно, от аминокиселини. Аминокиселинният състав на тези биомолекули определя триизмерната структура, която ще придобие.
Прочетете също: Как действат катализаторните вещества?
Ензимно-субстратен комплекс
Нарича се реактивен субстрат, върху който действа ензим. Когато ензимът се свърже със своя субстрат, комплексът се образува ензим-субстрат. Това свързване се извършва в специфичен регион, наречен активен сайт.
Когато говорим за ензими, базирани на протеини, активното място съответства само на няколко аминокиселини, като останалата част от молекулата е отговорна за определяне на конфигурацията на активния център. Формата на активното място, както и формата на субстрата са свързани със специфичността на ензима, тъй като те трябва да се допълват.
Модел с ключалка
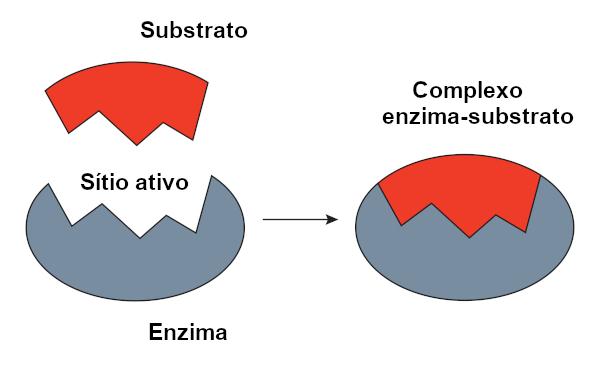
О ключ-ключ модел, предложен от Емил Фишер, се използва широко за обяснение на взаимодействието между ензима и субстрата. Според този модел има твърдо допълване между ензима и субстрата, точно като ключ и ключалка. Активното място на ензима ще има допълваща се форма към субстрата, която би паснала идеално. Следователно други молекули няма да имат достъп до това място, което би гарантирало специфичността на ензима. Точно както ключът отваря само ключалка, ензимът ще се свърже само със субстрат. Днес обаче знаем, че това модел не е правилен, тъй като ензимите не са твърди структури, както се смяташе досега.
Модел с индуциран монтаж
В момента най-приет модел за обяснение на връзката между ензима и неговия субстрат е един от щракване индуциран, първоначално предложено от Koshland et al. Активният сайт и субстратът не работят твърдо като ключ и ключалка. Изследванията показват, че когато субстратът навлезе в активното място, ензимът претърпява лека модификация, което благоприятства напасването между активното място и субстрата. За да разберем по-добре този модел, можем да мислим за взаимодействието между ензими и субстрати като ръкостискане, което става по-твърдо след първия контакт.
Кофактори
Повечето ензими се нуждаят от спомагателни молекули, за да осъществят своето каталитично действие, наречени кофактори. Кофакторите могат да бъдат постоянно прикрепени към ензима или могат да бъдат слабо и обратимо прикрепени към субстрата. Те също могат да бъдат неорганични или органични. Когато кофакторите са органични молекули, те се наричат коензими.
Някои витамини действат като коензими, например в случая на рибофлавин, известен също като витамин В2. Като примери за неорганични кофактори можем да споменем желязото и цинка в тяхната йонна форма.
Прочетете също: B-комплекс витамини - група витамини, които обикновено действат като коензими
Класификация на ензимите
Ензимите могат да бъдат класифицирани в шест групи, използвайки като критерий вида на реакцията, която катализират.
Оксидоредуктази: ензими, свързани с реакциите на оксирнамаляване.
Трансферази: катализира трансфера на групи от едно съединение в друго.
Хидролази: катализират реакциите на хидролиза.
Лиази: действайте чрез добавяне на групи към двойни връзки или премахване на групи, образуващи двойна връзка.
Изомерази: катализират реакции на изомеризация.
Връзки: ензими, които причиняват разграждането на молекулата на ATP, използвайки освободената в тази реакция енергия за образуване на нови съединения.
Фактори, които регулират ензимната активност
Активността на ензима се влияе от фактори, като основните са температурата и рН. Температурата обикновено играе положителна роля в химичните реакции, увеличавайки скоростта на ензимната реакция. Когато обаче температура увеличава се над оптималните условия, скоростта на реакцията спада значително. Това е така, защото се наблюдава денатурацията на протеини. Повечето човешки ензими имат оптимална температура между 35 и 40 ºC. В допълнение към температурата, рН той също влияе върху ензимната активност и освен това има оптимална стойност. За повечето ензими оптималната стойност на рН е в диапазона от 6 до 8.
От Ванеса Сардиня дос Сантос
Учител по биология