О точка на топене и кипене са съответно температурите, при които материалите се превръщат от твърдо в течно и от течно. за газ или максималната температура, при която течността може да остане в това състояние в дадено състояние натиск.
Точките на топене и кипене на химичните елементи в Периодичната таблица варират в зависимост от техните атомни номера, което тогава означава, че те са периодични свойства.
В Периодичната таблица редът на нарастване на температурите на топене и кипене на химичните елементи следва следната схема на стрелка:
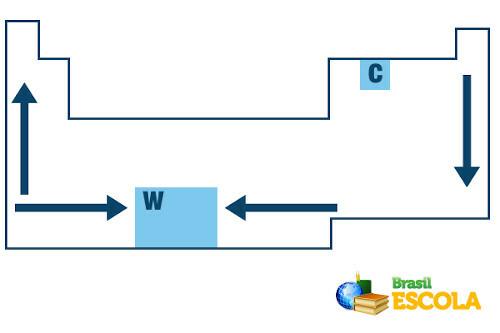
Нарастване на температурата на топене и кипене в Периодичната таблица
Имайте предвид, че когато разглеждаме елементите, принадлежащи към едно и също семейство от лявата страна на таблицата, точките на топене и кипене намаляват с увеличаване на атомния номер на елемента, т.е. отдолу до нагоре. Това може да се види от стойностите на температурата на топене и кипене при 1 атм за елементите от фамилия 1, показани по-долу:

Точки на топене и кипене на елементи от фамилия 1
От дясната страна на Периодичната система се получава обратното, посоката на растеж на точката на топене и кипене на елементите, принадлежащи към едно и също семейство, се увеличава отгоре надолу. Следователно елементите с най-ниски температури на топене и кипене са разположени в горната част на таблицата. Единственото изключение е въглеродът, който има точка на топене 3550 ° C и точка на кипене 4287 ° C.
В противен случай повечето от тези с ниски точки на топене и кипене са или газове, или течности със стайна температура на морското равнище. Както е в случая с благородните газове, азот, кислород, флуор и хлор, които се намират в горната дясна част на таблицата.
Сега, когато става въпрос за елементи, принадлежащи към същия период (същия ред в таблицата), виждаме, че точките на топене и кипене се увеличават от страните до центъра на таблицата. Вижте примера за елементите от втория период:
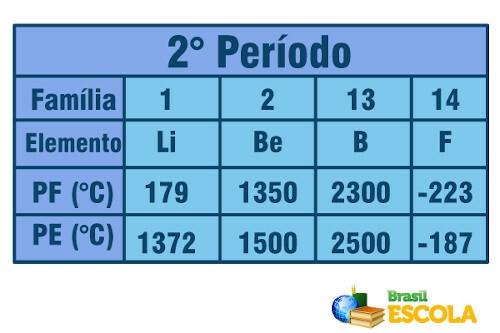
Точка на топене и точка на кипене за елементите от втория период на Периодичната система
Волфрамът (W) е елемент, който е в центъра на Периодичната таблица и точката му на топене е най-висока сред металите, равна на 3422ºC. Ето защо се използва при нажежаеми жички с нажежаема жичка, тъй като може да издържа на високи температури, без да се топи.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/ponto-fusao-ebulicaopropriedades-periodicas.htm

