О принципдаванесигурност, наричан още принцип на несигурността на Хайзенберг, беше заявен за първи път в 1927, от немския физик ВернерХайзенберг (1901-1976). Този принцип показва, че не е възможно да се измери, едновременно и със точност, пряко свързани количества, като например скорост и позиция на тяло.
Вижсъщо: Аспекти на квантовата теория
Обобщение на принципа на несигурност
Принципът на несигурност свързва две величини, като позиция и импулс или енергия и време, чрез произведението на несигурността на измерванията, извършени върху тях.
Според принципа на несигурността, колкото по-точно е положението на тялото, толкова по-малко точно е измерването на неговия импулс.
Принципът на несигурност гласи, че е невъзможно да знаем с пълна точност и в същото време две свързани физически величини, наричани още канонично конюгирани величини.
Какъв е принципът на несигурността на Хайзенберг?
О Принципът на несигурността на Хайзенберг е странен теоретичен резултат, получен чрез изчисления в областта на
Квантова механика, чиято основа е точно този принцип. Чрез познания по класическа физика се вярваше, че знаейки изходната позиция и скоростта, повече по-специално количеството на движение, на тяло или система от тела, би било възможно да се предскаже неговото поведение в бъдещи моменти. По този начин би било възможно да се изчисли длъжности по-късно, определяне на неговата траектория, стойности на ускорение,скорост,енергия, и т.н. Принципът на несигурност обаче показва, че дори да имаме Повече ▼необходимо от измервателните уреди под ръка, не би било възможно да знаем, едновременно и със точност, величие като позиция и суматавдвижение илиенергия и почивкаввреме на едно и също тяло.Вижсъщо: Количество на движение
Така че, според този принцип, ако можем да определим позиция на тяло с пълна точност, ние напълно ще загубим мярката му суматавдвижение, тъй като неточността около него ще се счита за безкрайна. По същия начин, ако можем да сме сигурни в количеството на движението на дадено тяло, няма да е възможно да знаем неговото положение.
Същото важи и за великите енергия и време: ако знаем точно количеството енергия в частицата, ще загубим точност при измерванията на времето. По същия начин, ако знаем колко време е настъпило дадено събитие с определена частица, ние напълно ще загубим информация за количеството енергия, налично в него.

Поради принципа на несигурност е невъзможно най-ниското енергийно ниво на тялото да бъде нула.
Вижсъщо: Какво представлява енергията?
Не всички физически величини са свързани помежду си поради тяхната степен на точност. Възможно е например да се определи енергия и позиция на частица без точността на тези измервания да е обратнопропорционален взаимно.
Освен това принципът на несигурността налага продуктът на несигурностите на две величини, като позиция и импулс, винаги да бъде по-голям или равен на Константа на Планк (h) разделено на 4π. Често е обаче да се види уравнението на принципа на несигурност, написано чрез константата на Планк намален (? = h / 2π).
Принципът на несигурността на Хайзенберг, който се отнася до несигурностдавапозиция на тяло с несигурност на нейния импулс, се определя чрез уравнението по-долу:
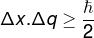
Δx - несигурност на позицията (m)
q - неопределеност на импулса (m / s)
? - намалена константа на Планк (1.0545.10−34 J.s)
Принципът на несигурност се прилага и към енергията и времевия обхват на тялото. Гледам:

Δ И -несигурност в енергията (J)
T -несигурност във времето (ите)
Да предположим например, че в даден експеримент искате да измерите позиция на електрон. За да може да се измери позицията му, е необходимо по някакъв начин да се излъчи фотон към този електрон. Когато обаче фотон се отразява обратно на наблюдателя, електронът отстъпва, тъй като фотонът прехвърля към него малко количество движение, пряко пропорционално на неговата честота. Ако искаме да определим по-точно положението на този електрон, можем да увеличим честотата на фотона. Ако обаче направим това, ще увеличим количеството движение, дадено на електрона, като по този начин ще загубим точността при измерване на тази величина.
Вижсъщо: Какво е теория на струните?
Решено упражнение на принципа на несигурност
Изключително точното лабораторно измерване е в състояние да определи позицията на молекулата с несигурности в реда, равен на ± 10-15 м. Според принципа на несигурност, каква е най-малката възможна несигурност при измерване на импулса на тази молекула?
Резолюция
Принципът на несигурност гласи, че произведението на несигурността на позицията и импулса трябва да бъде по-голямо или равно на половината от намалената константа на Планк:

По този начин, като вземем модула на несигурността на позицията (Δx = 10-15), осигурени от упражнението и намаления модул на константа на Планк (? = 1,0545.10−34 J.s), ще трябва:

Горният резултат показва, че дори лабораторията да разполага с някакъв инструмент, способен да измери количеството на движение на тази частица с грешки, по-малки от 10-20 м, няма да е възможно да се измери точно стойността му. По този начин винаги ще имаме изчислената по-горе стойност като отклонение плюс или минус.
От мен Рафаел Хелерброк
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-principio-incerteza.htm
