Реакции на сулфониране в алкани те са реакции на органично заместване, извършено с цел производство сулфонови киселини (органични съединения, които имат SO група3Н, прикрепен към въглероден атом или към въглеродна верига) и вода (Н2О).
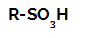
Структурна формула на сулфонова киселина
За провеждане на реакция на сулфониране на алкани, трябва да смесим алкан (съединение, образувано от въглеродна верига, наситена само с въглеродни и водородни атоми) и сярна киселина (H2САМО4) концентриран, подложен на нагряване (∆).
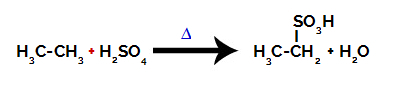
Химично уравнение, представляващо сулфонирането на двувъглероден алкан
Принципи на реакцията на сулфониране в алкани
Като реакция на сулфониране на алкан това е реакция на заместване, имаме обмен между по-малки компоненти електроотрицателност от реагентите, тоест между алкан и сярна киселина. Алканът има водород и сярна киселина, сулфоновата група.
По-долу имаме стъпка по стъпка на механизма на a сулфонационна реакция в алкани. Като пример ще използваме най-простия алкан, метан (СН4):
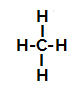
Структурна формула на метан
1-ва стъпка: Нарушаване на връзката между хидроксил (OH) и сяра (S) в сярна киселина.
Всяка хидроксилна група, присъстваща в сярна киселина, се характеризира с това, че е по-електроотрицателна. При нагряване по време на реакцията тенденцията е връзката между хидроксилната група и сярата да се прекъсне:
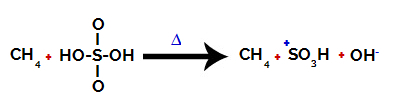
Нарушаване на връзката между сяра и хидроксил
Разкъсването на връзката на всички хидроксили обаче не възниква поради електронното пренареждане в структурата. След това се получава хидроксиден анион (OH).-) и сулфонов катион.
2-ра стъпка: Атака на хидроксилна група върху молекулата на алкана.
След това хидрокси групата (OH-) извършва атака върху алкана, причинявайки прекъсване на връзката между въглерод и водород (който е по-крехък поради разликата в електроотрицателността между тях).
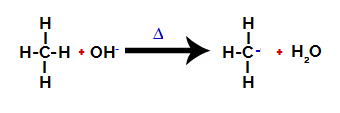
Разкъсване на връзката между въглерод и водород в алкан
Забележка: Нарушаването на връзката между въглерод и водород винаги ще се случва най-често при въглерод с по-ниска електронна плътност или заряд. Колкото по-малко водороди има въглеродът или колкото повече групи са свързани към него, толкова по-ниска е неговата електронна плътност. Така че имаме:
Третичен въглерод
След прекъсване на връзката алканът се превръща в въглерод с дефицит на електрони (карбокатион). Хидроксидната група (OH)-) взаимодейства с освободения водород и образува водна молекула.
3-та стъпка: Атака на образувания радикал върху сулфоновата група.
И накрая, сулфоновата група е атакувана от останалата част от алкана, образувайки сулфонова киселина.
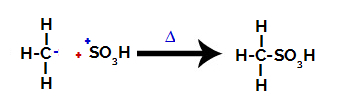
Структури, които взаимодействат и образуват сулфонова киселина
Примери за уравнения, представляващи реакции на сулфонация в алкани
1-ви пример: Сулфониране на пропан.
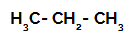
Структурна формула на пропан
Пропанът има два първични въглерода и един вторичен въглерод, които имат различни заряди, тъй като са свързани с различни количества водород. Тъй като въглеродът е по-електроотрицателен от водорода, тези въглероди имат различна електронна плътност.
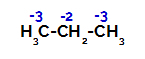
Разпределение на зарядите върху всеки въглероден атом на пропан
При първичните въглероди зарядът е -3 (тъй като е свързан с три водорода), а при вторичния въглерод зарядът е -2 (тъй като е свързан с два водорода). По този начин ще има прекъсване на връзката между въглерод и водород, понякога при въглерод 1 (на една молекула), понякога при въглерод 2 (на друга молекула).
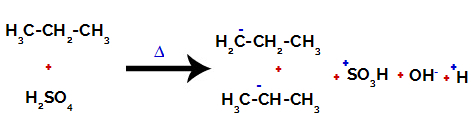
Разкъсване на връзката между въглерод и водород върху различни въглероди
След прекъсванията между връзките, както в сярна киселина, така и в алкан, се образува продукти със заместване на водорода върху въглерод 1 със сулфонова група, а същото се случва и при въглерода 2.
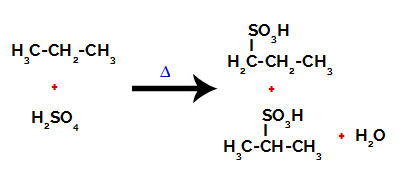
Продукти, образувани от сулфонирането на пропан
2-ри пример: Сулфониране на 2-метил-бутан.

Структурна формула на 2-метил-бутан
2-метил-бутанът има три първични въглерода, вторичен въглерод и третичен въглерод, които имат различни заряди и следователно различна електронна плътност, както може да се види в следната структура:
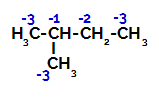
Разпределение на електронни заряди в 2-метил-бутан
Следователно, в 2-метил-бутана има няколко възможности за разрушаване на връзката между въглерод и водород, които могат да възникнат върху въглерод 1 (на молекула), въглерод 2 (на друга молекула), въглерод 3 или въглерод 4. Забележително е обаче, че разрушаването при въглерод номер 2 е по-често.
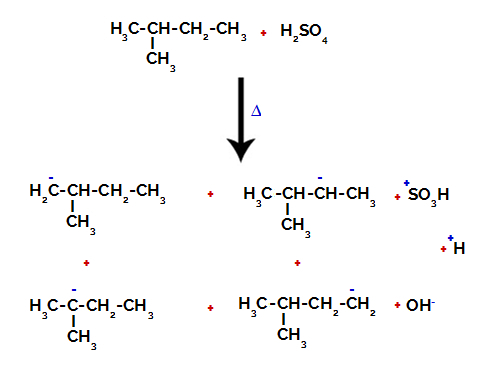
Разкъсване на връзката между въглерод и водород върху различни въглероди
След счупването на връзките, както в сярна киселина, така и в алкан, образуването на продукти със заместване на водорода на въглерод 1 със сулфонова група, а същото се случва и на въглерод 2.

Продукти, образувани от сулфонирането на 2-метил-бутан
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm

