Изгарянето е екзотермична химическа реакция между два регента, гориво и окислител, при която енергията се отделя под формата на топлина.
- Гориво: Това е окисляемото вещество, отговорно за подхранването на горенето. Примери: бензин, дърва, готварски газ, алкохол и дизел.
- окисляващ: Това е веществото, което засилва горенето. В повечето случаи окислителят е кислороден O газ2.
Изгарянето се извършва само в присъствието на гориво и окислител. По този начин той се прекратява или прекъсва само поради липсата на един от тези реактиви.
Изгарянето е много често в ежедневието, то присъства в изгарянето на готварски газ, автомобилни горива, свещи, дърво, хартия и др.
 Изгарянето на дърва е пример за горене
Изгарянето на дърва е пример за горене
Видове
Органичните съединения имат два вида горене, пълно и непълно.
Пълно изгаряне
Пълното изгаряне е това, което има достатъчно кислород, за да консумира горивото. Представя като продукти CO2 (Въглероден двуокис) и Н2О (Вода).
Пълното изгаряне има по-голямо отделяне на топлина.
Примери:
а) Пълно изгаряне на етанол (C2Н6O):
° С2Н6O + O2 → CO2 + Н2О
При балансиране на реакцията:
° С2Н6O + 3 O2 → 2 CO2 + 3 Н2О
В тази реакция количеството кислород беше достатъчно, за да погълне целия метанол и да произведе като продукти CO2 и Н2О.
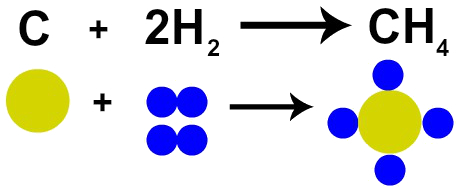
б) Пълно изгаряне на метан (СН4):
CH4 + O2 → CO2 + Н2О
CH4 + O2 → CO2 + 2 Н2О
Непълно изгаряне
При непълно изгаряне няма достатъчно кислород за пълно изразходване на горивото.
Той има два вида продукти: CO (Въглероден окис) или сажди (C), вещества, които са токсични за околната среда и вредни за здравето.
При непълно изгаряне се отделя по-малко топлина.
Примери:
а) Непълно изгаряне на етанол:
° С2Н6O + 2 O2 → 2 CO + 3 H2O = Производство на CO и H2О.
° С2Н6O + O2 → 2 C + 3 H2O = Производство на сажди и Н2О.
Имайте предвид, че между двете реакции има намаляване на количеството кислород, това представлява по-малко количество отделена топлина.
б) Непълно изгаряне на метан:
CH4 + 3/2 O2 → CO + 2 H2О
CH4 + O2 → C + 2H2О
Прочетете и вие:
- Окисление
- Химична реакция
- Ендотермични и екзотермични реакции
- термохимия
Енталпия на горенето
Енталпията (H) на горенето или топлината на горене е енергията, отделяна от изгарянето на 1 мол гориво при стандартни условия (температура: 25 ° C; Налягане: 1 атм).
Тъй като горенето е екзотермична реакция, промяната на енталпията (∆H) винаги ще има отрицателна стойност.
Енталпията на горенето може да се изчисли, като се използва следната формула:
ΔH = Hпродукти - З.реагенти
Спонтанно възпламеняване
Спонтанното горене е това, което се извършва без съществуването на външен запалим източник.
Това се случва с някои материали, способни да акумулират много топлина вътре в тях, увеличавайки скоростта на химичните реакции. Това условие повишава температурата на материала, докато се извърши горенето.
Все още има доказателства за спонтанно изгаряне на човека (CHE), при което тялото изгаря без никакво влияние от външни източници.
Първият запис на този случай щеше да се случи на жена, докато тя спеше, през 1663 година. Други подобни случаи също са свързани със спонтанно изгаряне на човека.
Науката обаче все още се опитва да разбере как протича процесът в човешкото тяло. В момента има само няколко теории, които обясняват явлението.
Вижте също: Пожар