Тъй като има хиляди органични съединения, явлението изомерия може да приеме няколко форми. Следователно изомеризмът може да бъде класифициран в два вида: плоска или конституционна изомерия и космическа изомерия или стереоизомерия. Всеки споменат тип може да бъде подразделен, както е показано на следната диаграма:
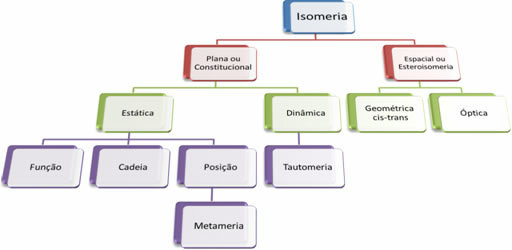
Вижте всеки случай:
1. Плоска или конституционна изомерия: Изомерите от този тип имат еднаква молекулна формула и се отличават с плоски структурни формули. Има пет случая на равнинна изомерия: функция, верига, позиция, метамеризъм и тавтомеризъм.
1.1.Функционална или функционална изомерия: Разликата между изомерите е във функционалната група.
Пример: Молекулярна формула С3Н6О
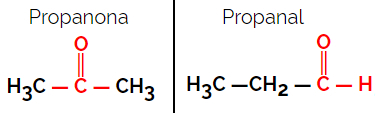
Имайте предвид, че пропанонът е от кетонната група, а пропаналът е от алдехидната група.
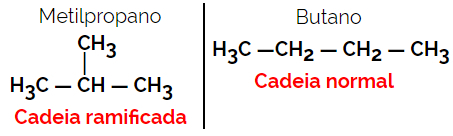
1.2. Верижни или скелетни изомери: Разликата между изомерите е във вида на веригата. Например, единият изомер е с отворена верига, а другият със затворена верига, или единият е с нормална верига, а другият с разклонена верига, или единият е хомогенна верига, а другият е хетерогенна верига.
Пример: Молекулярна формула С4Н10
1.3.Позиционна или позиционна изомерия: Разликата е в позицията на ненаситеност, функционална група, хетероатом или заместител.
Пример: Молекулярна формула С4Н6

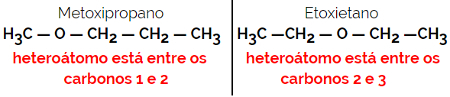
1.4.Компенсационна изомерия или метамерия: Това е специален тип позиционна изомерия, където разликата е позицията на хетероатома.
Пример: Молекулярна формула С4Н10О
1.5.Динамична изомерия или тавтомерия: Това е специален тип функционална изомерия, при която изомерите съществуват в динамично равновесие в разтвор. Двата основни типа тавтомерия са между кетон и енол (кетоенолен баланс) и между алдехид и енол (баланс на алдоенола).
Пример: Молекулярна формула С3Н6О
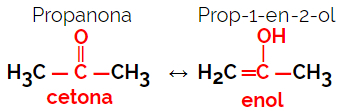
2. Космическа изомерия или стероизомеризъм: В този случай разликата между изомерите може да се визуализира само чрез ориентацията на техните атоми в пространството. Има два вида стереоизомерия: геометрична изомерия и оптична изомерия.
2.1.Геометрични или цис-транс изомери: Разликата е, че изомерът, наречен като цис той има същите въглеродни лиганди в двойна връзка или в циклични съединения от същата страна на равнината. Изомерните лиганди транс са на противоположни страни.
Пример: Молекулярна формула С2Н2Cl2

Тези съединения се наричат стереоизомери.
2.2.Оптичен изомер: Възниква, когато изомерите са в състояние да отклонят лъч поляризирана светлина. Ако огъне поляризирания светлинен лъч наляво, това е леворотарен изомер, но ако се огъне надясно, се нарича десен изомер.
Пример:
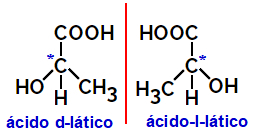
Наричат се асиметрични молекули като показаните по-горе, които са огледални изображения един на друг и които не могат да се наслагват едно върху друго. енантиомери.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
