Някои съединения не трябва да имат осем електрона във валентната обвивка, за да постигнат стабилност, така че те се считат за изключения от правилото на октета. Научете сега защо някои елементи избягват задължението да имат октет от електрони в последната обвивка.
Берилий (Бъда)
Това е изключение от правилото на октета, тъй като е способно да образува съединения с две единични връзки, така че се стабилизира само с четири електрона във валентната обвивка. 
Тъй като водородът (H) трябва да се откаже от два електрона, за да направи връзката (Н - Ами - Н), атомът Берилий (Be) споделя своите електрони и постига стабилност.
Алуминий (Ал)
Това е изключение от правилото на октета, тъй като то постига стабилност с шест електрона във валентната обвивка. Алуминиевият атом е склонен да отдаде своите електрони и така може да образува три единични връзки с други атоми: 
В този случай алуминият (Al) образува три връзки с три флуорни (F) атома.
Бор (Б)
Той образува молекулни вещества с три единични връзки.
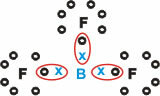
Имайте предвид, че борът (B) има тенденция да дарява своите електрони на флуорни (F) атоми, който се подчинява на правилото на октета, изисквайки осем електрона във валентната обвивка. Тъй като борът се отказва от електроните си, флуорът се стабилизира с образувания октет.
От Лирия Алвес
Завършва химия
Училищен отбор на Бразилия
Виж повече!
Теория на октетите
Обща химия - Химия - Бразилско училище
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm
