Лоренцо Романо Амедео Карло Авогадро (1776-1856) е италиански химик, който за първи път установява идеята, че проба от елемент, с маса в грамове, числено равна на атомната му маса, винаги има еднакъв брой атоми (Н).
Самият Авогадро не успя да определи стойността на N. През целия ХХ век обаче напредъкът на технологиите и научните познания дава възможност на други учени да разработят техники за нейното определяне. Когато тази стойност беше най-накрая открита, тя беше извикана Константата на Авогадро, в чест на този учен, тъй като именно той положи основите за неговото създаване.

Лоренцо Романо Амедео Карло Авогадро (1776-1856)
В 1 мол от която и да е същност (атоми, молекули, електрони, формули или йони) се съдържа точно стойността на константата на Авогадро.
Таблицата по-долу показва някои стойности за константата на Авогадро, получени през 20-ти век:
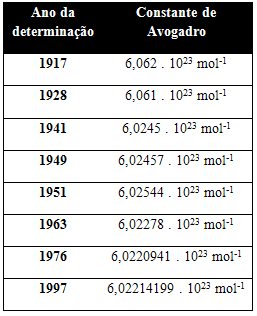
Ето някои от техниките, използвани за определяне на стойността на константата на Авогадро:
Първият учен, който направи приблизително изчисление за константата на Авогадро, беше Йохан Йозеф Лошмид. През 1867 г. той се основава на кинетичната теория на газовете и определя колко молекули съществуват в 1 cm
3 на газ.Друг от тези учени е французинът Жан Батист Перен (1870-1942), който преброява броя на колоидните частици на единица обем в суспензия и измерва техните маси. Стойността, която той намери, беше между 6,5 и 7,2. 1023 единици на мол. Този учен публикува книгата през 1913 г. Les Atomes (1-во изд. Париж: Алкан) и неговото 9-то издание, публикувано през 1924 г., съдържа 16 начина за експериментално получаване на константата на Авогадро.

Жан Батист Перин (1870-1942)
Години по-късно ученият Джеймс Деуар (1842-1923) използва метод, разработен години по-рано от радиохимика Бертрам Болтууд (1870-1927) и физика Ърнест Ръдърфорд (1871-1937), който основно се състоеше от преброяване на алфа частиците, излъчвани от радиоактивен източник и определяне на обема на получения хелий газ. Стойността, намерена от Dewar, е 6.04. 1023 мол-1.
Още през 20 век Робърт Миликан (1868-1953) провежда експеримент за определяне на заряда на електрона (1.6. 10-19 ° С). Тъй като зарядът от 1 мол електрони вече беше известен (96500 С), беше възможно да се свържат тези две стойности и да се намери следната стойност за константата на Авогадро: 6.03. 1023 мол-1.
В момента препоръчителната стойност за константата на Avogadro е 6.02214 x 1023 мол-1 и се определя чрез рентгенова дифракция, при която се получава обемът на няколко атома на кристална решетка, стига да са известни плътността и масата на 1 мол атоми в пробата.
За дидактически цели, в гимназията, където изчисленията не трябва да бъдат толкова точни, колкото тези, извършвани в химически лаборатории, константата на Авогадро се счита за 6,02. 1023 мол-1.
Съществуват и по-прости методи, които могат да се използват, за да помогнат на учениците да определят постоянната константа на Авогадро на практика. Един от тях е чрез електролиза във водна среда.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm

